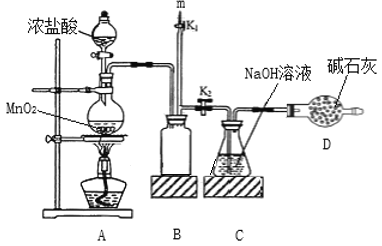
题目内容
【题目】在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应,n(NO)随时间的变化如下表:
时间/S | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为___________。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是______热反应(填:“吸”、“放”)
(3)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是_______。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.可能是缩小了容器的体积
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式_________。
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,平衡时NO的转化率a___b(填“大于”“小于”“等于”)

【答案】0.0015molL-1s-1 放热 C 2NO(g)+O2(g)![]() 2NO2(g) H= -12.5akJmol-1 <
2NO2(g) H= -12.5akJmol-1 <
【解析】
(1)从0~20s,NO气体物质的量由0.20mol减小到0.08mol,则参加反应的NO为0.12mol,参加反应的O2为0.06mol,由此可求出用O2表示的该反应的速率。
(2)若升温到850℃,平衡后n(NO)= n(NO2)=0.10mol,则表明平衡逆向移动。
(3)A.移去部分NO,平衡向逆反应进行;
B.向容器中加入了一定量的NO气体,虽然平衡正向移动,但平衡时NO的物质的量增大;
C.缩小了容器体积,相当于加压,平衡正向移动。
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,则0.16molNO完全反应,放出热量akJ,由此可求出2molNO参加反应,放出热量12.5akJ,便可写出在此条件下该反应的热化学方程式。
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,随着反应的进行,混合气的物质的量减小,b容器为恒压容器,则b中活塞不断左移,相当于a容器加压,平衡正向移动,由此可确定平衡时NO的转化率a与b的关系。
(1)从0~20s,NO气体物质的量由0.20mol减小到0.08mol,则参加反应的NO为0.12mol,参加反应的O2为0.06mol,v(O2)=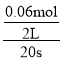 =0.0015molL-1s-1。答案为:0.0015molL-1s-1;
=0.0015molL-1s-1。答案为:0.0015molL-1s-1;
(2)若升温到850℃,平衡后n(NO)= n(NO2)=0.10mol,则表明平衡逆向移动,该反应是放热反应。答案为:放热;
(3)改变某一条件,是NO的物质的量从0.07mol减小到0.06mol,
A.移去部分NO,平衡向逆反应进行,A不正确;
B.向容器中加入了一定量的NO气体,虽然平衡正向移动,但平衡时NO的物质的量增大,B不正确;
C.缩小了容器体积,相当于加压,平衡正向移动,C正确;
故选C。答案为:C;
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,则0.16molNO完全反应,放出热量akJ,由此可求出2molNO参加反应,放出热量12.5akJ,此条件下该反应的热化学方程式为2NO(g)+O2(g)![]() 2NO2(g) H= -12.5akJmol-1。答案为:2NO(g)+O2(g)
2NO2(g) H= -12.5akJmol-1。答案为:2NO(g)+O2(g)![]() 2NO2(g) H= -12.5akJmol-1;
2NO2(g) H= -12.5akJmol-1;
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,随着反应的进行,混合气的物质的量减小,b容器为恒压容器,则b中活塞不断左移,相当于a容器加压,平衡正向移动,NO的转化率增大,由此可确定平衡时NO的转化率a<b。答案为:<。

【题目】苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸和甲醇为原料制备苯甲酸甲酯。有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(gcm-3) | 水溶性 | |
苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。回答下列问题:
(1)该反应的化学方程式为_____。
(2)实验中,应选择_____(填序号)作为冷凝回流装置,该仪器的名称为_____。

(3)使用过量甲醇的原因是_____。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。

(4)饱和碳酸钠溶液的作用是_____,操作b的名称为_____。
(5)该实验中制得苯甲酸甲酯8.5g,则苯甲酸甲酯的产率为_____。