题目内容
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g)  CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
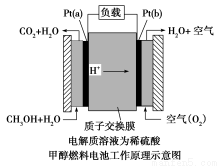
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ,CO的转化率为 。
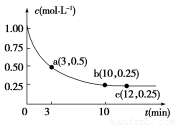
(2)该反应的平衡常数表达式为 ,温度升高,平衡常数 (填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向 (填“正”、“逆”)反应方向移动,理由是 。
(1)0.15 mol·L-1·min-1 75%
(2)K= 减小
减小
(3)正 反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积减小,平衡正移
【解析】解答该题应该注意下面三点:
(1)根据图一和已知反应方程式计算反应速率及转化率。
(2)根据图二判断反应过程中的能量变化及反应是吸热反应还是放热反应,从而判断平衡常数随温度的变化。
(3)ρ=m/V,质量不变,密度增大,体积减小,从而判断反应方向。

物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
阳离子 | NH4+、H+、Na+ |
阴离子 | OH-、CH3COO-、Cl- |
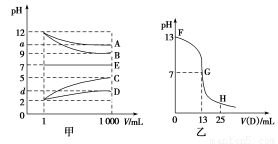
(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
下列物质中,属于强电解质的是 (填序号,下同);属于弱电解质的是 ;属于非电解质的是 。
①氨气;②氨水;③盐酸;④醋酸(CH3COOH);⑤硫酸钡;⑥氯化银;⑦氯化钠溶液;⑧二氧化碳;⑨醋酸铵;⑩氢气
利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)??2CO2(g)+N2(g) ΔH<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂的比表 面积(m2·g-1) |
Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
Ⅱ |
| 1.2×10-3 |
| 124 |
Ⅲ | 350 |
|
| 82 |
(1)请填全表中的各空格;
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。

下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质
可在空气中燃烧。
W | X | Y |
|
| Z |
请回答下列问题:
(1)Z的元素符号是 ,写出Z的原子结构示意图: 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为 。
(3)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
1 |
|
|
2 |
|
|
(4)由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式: 。