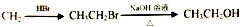题目内容
往相同浓度、相同体积的NaOH溶液中分别加入pH为3和4的醋酸,使其刚好完全反应,若消耗两种醋酸溶液的体积分别为V1和V2,则V1、V2的关系是( )
| A、V2=10V1 |
| B、V2<10V1 |
| C、V2>10V1 |
| D、V1=10V2 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:醋酸为弱电解质,醋酸的浓度越大,电离程度越小,设pH为3和4的醋酸的电离度分别为a1、a2,则a1<a2,据此列式计算出醋酸的物质的量浓度,再根据消耗氢氧化钠的物质的量相等,说明两溶液中含有醋酸的物质的量相等,据此列式比较V1和V2的大小.
解答:
解:同浓度、相同体积的NaOH溶液中分别加入pH为3和4的醋酸,使其刚好完全反应,说明两醋酸溶液中含有的醋酸的物质的量相等,
设pH为3和4的醋酸的电离度分别为a1、a2,则a1<a2,
V1体积 pH为3的醋酸溶液中含有醋酸的物质的量为:n=cV=
×V1,
V2体积 pH为4的醋酸溶液中含有醋酸的物质的量为:n=cV=
mol/L×V2,
则
×V1=
mol/L×V2,
整理可得:
=
×
,
由于a1<a2,
<1,
所以
<
,
即V2>10V1,
故选C.
设pH为3和4的醋酸的电离度分别为a1、a2,则a1<a2,
V1体积 pH为3的醋酸溶液中含有醋酸的物质的量为:n=cV=
| 1×10-3mol/L |
| a1 |
V2体积 pH为4的醋酸溶液中含有醋酸的物质的量为:n=cV=
| 1×10-4 |
| a2 |
则
| 1×10-3mol/L |
| a1 |
| 1×10-4 |
| a2 |
整理可得:
| V1 |
| V2 |
| 1 |
| 10 |
| a1 |
| a2 |
由于a1<a2,
| a1 |
| a2 |
所以
| V1 |
| V2 |
| 1 |
| 10 |
即V2>10V1,
故选C.
点评:本题考查了酸碱混合的定性判断及溶液酸碱性与溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确醋酸的浓度越大,醋酸的电离程度越小.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列分离提纯方法不正确的是( )
| A、分离碘和氯化钠,用升华法 |
| B、分离硝酸钾和氯化钠固体,先加水溶解再用过滤法 |
| C、除去酒精中少量的水,先加生石灰再用蒸馏法 |
| D、分离苯和酸性高锰酸钾溶液,用分液法 |
下列表示对应化学反应的离子方程式正确的是( )
A、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| B、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| C、将少量醋酸溶液滴加到Na2CO3溶液中的反应:CH3COOH+CO32-=CH3COO-+HCO3- | ||||
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
下列叙述中正确的是( )
| A、碘易升华,所以要保存在铁盖旋紧的试剂瓶中 |
| B、液溴应保存在磨口玻璃塞棕色细口试剂瓶中,并加少量水进行水封 |
| C、碘易溶于酒精,所以可用酒精从碘水中将碘萃取出来 |
| D、用加热的方法可将碳酸氢钠中混有的少量碘除去 |
下列关于某些社会热点问题的说法中,不正确的是( )
| A、光化学烟雾的产生与碳氢化合物、氮氧化物的排放有关 |
| B、禁止使用含铅汽油是为了提高汽油的燃烧效率 |
| C、臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关 |
| D、甲醛是某些劣质装饰板材释放的常见污染物之一 |
X、Y、Z均为短周期元素,在周期表中的位置如图所示,下列叙述正确的是( )
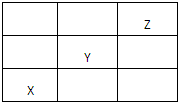

| A、X一定是活泼金属 |
| B、Y的最高价氧化物是酸性氧化物 |
| C、Z的单质是双原子分子 |
| D、氢化物的稳定性:Y>X |
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,下列叙述正确的是( )
| A、X、Y、Z的稳定性逐渐增强 |
| B、X、Y、Z三种化合物的熔沸点逐渐升高 |
| C、A、B、C、D只能形成四种单质 |
| D、只含有A、B、C、D 四种元素的化合物有两种 |
春运期间,一些易燃、易爆、剧毒品、腐蚀品等,严禁带上客车.在下列化学药品中允许带上客车的是
( )
( )
| A、浓硫酸 | B、氰化钾 |
| C、汽油 | D、漂白粉 |
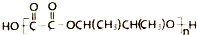 的合成路线流程图(无机试剂任用).合成路线流程图如图:
的合成路线流程图(无机试剂任用).合成路线流程图如图: