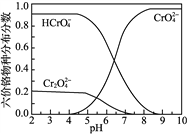
题目内容
【题目】小华在实验室进行以下实验:将四个完全相同的空心薄铁皮球分别放入四个盛有密度为ρ(g/cm3)的食盐水的烧杯中,铁球所处的位置如图所示。然后,他将水、密度均为ρ(g/cm3)的三种溶液(CuSO4、AgNO3、稀硫酸)分别加入上述四个烧杯中。回答下列问题:
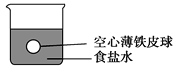
(1)加入水时,看到的现象是____________________________________________。
(2)加入稀硫酸时看到的现象是(假定整个反应过程中铁皮球壁完整)_____________________,发生反应的离子方程式是____________________________________________。
(3)加入CuSO4溶液时看到的现象是___________________________,发生反应的离子方程式是____________。
(4)加入AgNO3溶液时看到的现象是____________,发生反应的离子方程式是____________________。
【答案】铁球下沉铁球表面产生气泡并慢慢上浮Fe+2H+=== Fe2++H2↑铁球表面变红,铁球下沉Fe+Cu2+=== Cu+Fe2+溶液中有白色沉淀,铁球下沉,继而表面有银白色物质生成Ag++Cl=== AgCl↓、Fe+2Ag+=== 2Ag+Fe2+
【解析】
(1)加入水时,与食盐及铁球不反应,但加水后,溶液密度变小,故小球下沉;
(2)加入稀硫酸时,虽不能与食盐反应,但可与铁球发生反应,生成氢气,铁球质量减小,生成硫酸亚铁,溶液密度增大,故小球上浮,其发生的离子方程式为Fe+2H+=Fe2++H2↑;
(3)加入硫酸铜溶液时,铁将硫酸铜中的铜置换出来,发生反应,但生成的铜比溶解的铁质量更大且附着在铁球上,故小球下沉,其发生的离子方程式为Fe+Cu2+=Fe2++Cu;
(4)加入硝酸银后发生反应生成氯化银沉淀,溶液中出现白色沉淀后密度变小,小球下沉,此过程中铁可能将硝酸银中的银置换出来,使铁球表面析出银白色物质。发生的离子方程式为Ag++Cl-=AgCl↓、Fe+2Ag+=Fe2++2Ag。