题目内容
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:
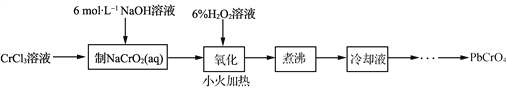
已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水。
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10-13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
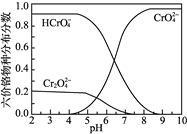
③六价铬在溶液中物种分布分数与pH关系如右图所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成。
(1)实验时需要配制100 mL 3mol·L-1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要的玻璃仪器是________。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是________。
(3) “氧化”时H2O2滴加速度不宜过快,其原因是____________________________;“氧化”时发生反应的离子方程式为__________________________________________________。
(4) “煮沸”的目的是________。
(5) 请设计用“冷却液”制备PbCrO4的实验方案:________[实验中须使用的试剂有:6 mol·L-1的醋酸, 0.5 mol·L-1Pb(NO3)2溶液, pH试纸]。
【答案】 100 mL容量瓶和胶头滴管 不断搅拌下逐滴加入NaOH溶液,至产生的绿色沉淀恰好溶解 减小H2O2自身分解损失 2CrO![]() +3H2O2 +2OH-===2CrO
+3H2O2 +2OH-===2CrO![]() +4H2O 除去过量的H2O2 在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸至弱酸性(pH略小于7),将溶液加热至沸腾,先加入一滴0.5 mol·L-1 Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥
+4H2O 除去过量的H2O2 在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸至弱酸性(pH略小于7),将溶液加热至沸腾,先加入一滴0.5 mol·L-1 Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥
【解析】(1)配置100mL3mol·L-1CrCl3溶液,需要的最关键的玻璃仪器是100mL容量瓶和胶头滴管;
(2)由于Cr(OH)3是两性氢氧化物,难溶于水的绿色沉淀,所以滴加NaOH溶液时,要在不断搅拌下直到绿色沉淀恰好完全溶解,即到NaCrO2溶液;
(3)H2O2用于将NaCrO2氧化为Na2CrO4,但H2O2不稳定,易分解,所以滴加速率不宜过快;反应的离子方程式为2CrO2-+3H2O2+2OH- =2CrO42-+4H2O;
(4)“煮沸”的目的是为除去过量的H2O2;
(5)“冷却液”的主要成分为Na2CrO4,要想制备PbCrO4,根据已知信息②由Pb(NO3)2提供Pb2+,但要控制溶液的pH不大于7.2,以防止生成Pb(OH)2沉淀,由信息③的图象可知,溶液的pH又不能小于6.5,因为pH小于6.5时CrO42—的含量少,HCrO4—的含量大,所以控制溶液的pH略小于7即可,结合信息④,需要先生成少许的PbCrO4沉淀,再大量生成。所以实验操作为:在不断搅拌下,向“冷却液”中滴加6mol·L-1的醋酸至pH略小于7,将溶液加热至沸,先加入一滴0.5mol·LPb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案