题目内容
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某化学兴趣小组将无水三草酸合铁酸钾按如图所示装置进行实验。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
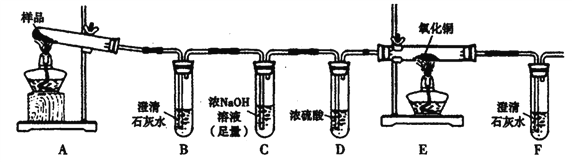
限选试剂:浓硫酸、1.0mol/L HNO3、1.0mol/L盐酸、1.0 mol/L NaOH.3% H2O2、0.1 mol/LKI、0.1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
I.若实验中,观察到B、F中溶液均变浑浊,则E中的现象是____,推测三草酸合铁酸钾分解的气体产物是____。该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设:假设l____;假设2____;假设3____。
(2)设计实验方案并验证
①取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
②取少量上述不溶固体放入试管中,加入足量____溶液,充分振荡。若溶液颜色及加入的不溶固体无明显变化,则假设____成立。若溶液颜色明显改变,且有暗红色固体生成,则证明有____存在。
③取②所得暗红色固体于试管中,滴加过量____,振荡后静置。取上层清液于试管中,滴加适量____,再滴加____,若溶液基本无色,则假设____成立;若溶液呈____,则假设_____成立。
【答案】 黑色粉末变红 CO和CO2 只有Fe 只有FeO 含有FeO和Fe CuSO4溶液 2 Fe HCl 20%KSCN 3%H2O2 1 血红色 3
【解析】试题分析:本题考查三草酸合铁酸钾晶体分解产物的实验探究。涉及CO2、CO的检验,Fe、FeO的性质以及Fe2+的检验,实验方案的设计。
I.若实验中观察到B中澄清石灰水变浑浊,说明分解产物中有CO2;通过C中足量的浓NaOH溶液将CO2除尽;观察到F中澄清石灰水变浑浊,说明产物通过灼热的CuO时生成了CO2,E中CO将CuO还原成Cu,则E中的现象为黑色粉末变红;根据上述现象推测三草酸合铁酸钾分解的气体产物为CO和CO2。
II.(1)固体产物中铁元素不可能以三价形式存在,则固体产物中Fe可能是0价、+2价,固体产物中铁元素存在形式的合理假设为:假设1只有Fe,假设2只有FeO,假设3为Fe和FeO的混合物。
(2)①固体产物加入足量蒸馏水溶解,过滤除去固体产物中的可溶性的K2CO3。
②根据题给试剂,以及Fe和FeO的性质,Fe能从CuSO4溶液中置换出暗红色的Cu,FeO与CuSO4溶液不反应,可向不溶固体中加入CuSO4溶液,观察CuSO4溶液颜色的变化确定固体产物中是否含Fe。取少量上述不溶固体放入试管中,加入足量CuSO4溶液,充分振荡;若溶液颜色及加入的不溶固体无明显变化,固体产物中不含Fe,则假设2成立;若溶液颜色明显改变,且有暗红色固体生成,固体产物中存在Fe。
③要确定暗红色固体中是否含FeO,可将暗红色固体溶于盐酸后再检验是否含Fe2+。实验方法是:取②所得暗红色固体于试管中,滴加过量1.0mol/LHCl,振荡后静置。取上层清液于试管中,滴加适量20%KSCN溶液,再滴加3%H2O2,若溶液基本无色,则暗红色固体中不含FeO,则假设1成立;若溶液呈血红色,则暗红色固体中含FeO,则假设3成立。