题目内容
下列依据热化学方程式得出的结论正确的是
| A.已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
C
解析试题分析:A. 燃烧热是一摩尔的物质完全燃烧产生稳定的氧化物时所放出的热量。气态的水不是稳定的状态。氢气的燃烧热大于241.8 kJ/mol错误。B.物质含有的能量越低物质就越稳定。由于石墨变为金刚石时吸收热量,所以石墨比金刚石稳定。错误。C.物质发生反应的越多,产生的热量也就越多。产生的热量和反应的物质的多少呈正比。正确。D.碳单质燃烧,无论是完全燃烧还是不完全燃烧,都是放出热量的。燃烧越充分,放出的热量就越多所以ΔH2>ΔH1。错误。
考点:考查反应热的计算和热化学方程式的书写的知识。

练习册系列答案
相关题目
如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 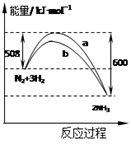
A.该反应的热化学方程式为:2NH3  N2+3H2ΔH =-92 kJ·mol-1 N2+3H2ΔH =-92 kJ·mol-1 |
| B.正反应的活化能小于逆反应的活化能 |
| C.a曲线是加入催化剂时的能量变化曲线 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
已知H2(g)+ Br2(l)→ 2HBr(g)+ 42 kJ。1mol Br2(g)液化放出的能量为30 kJ,其它相关数据如下表:
| | H2(g) | Br2(g) | HBr(g) |
| 1 mol 分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
A、404 B、344 C、230 D、200
下列说法或表示方法正确的是( )
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 |
| B.31g红磷变成31g白磷要吸收能量,说明白磷比红磷更稳定 |
| C.在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol |
| D.2A (l) + B (l) =" 2C" (l) △H1 2A (g) + B (g) =" 2C" (l)△H2 则ΔH1>ΔH2 |
下列依据热化学方程式得出的结论正确的是
| A.若2H2(g)+O2(g) =2H2O(g) ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1 |
| B.若C(石墨,s) =C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=—57.4 kJ·mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D.已知2C(s)+2O2(g) =2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1>ΔH2 |
下列关于热化学反应的描述中正确的是( )
| A.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+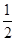 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2800 kJ·mol-1,则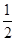 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 |
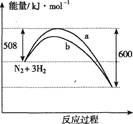
在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
| A.该反应的热化学方程式为: N2+3H2  2NH3ΔH =-92 kJ·mol-1 2NH3ΔH =-92 kJ·mol-1 |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.图中曲线b表示使用了催化剂 |
下列说法正确的是( )
| A.物质的化学变化都伴随着能量变化 |
| B.凡是吸热反应都需要加热 |
| C.任何反应中的能量变化都表现为热量变化 |
| D.拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
