题目内容
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E
分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置________________________________________________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为________;工业生产该化合物和单质F的离子方程式为_________________________________________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为________________________________________________________________________。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为_________________________________________________________________________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为____________。
0.1 mol·L-1该化合物水溶液中的离子浓度由大到小的顺序为_________________________________________________________。
(1)第三周期第Ⅶ A族
(2)NaOH2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(3)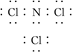
(4)2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ·mol-1(或SO2(g)+1/2O2(g)=SO3(g)ΔH=-98.3 kJ·mol-1)
(5)离子键和(极性)共价键 c(NO3-)>c(NH4+)>c(H+)>c(OH-)
解析

元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。
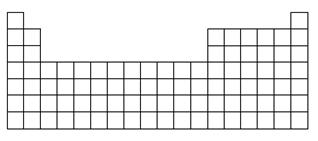
(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。