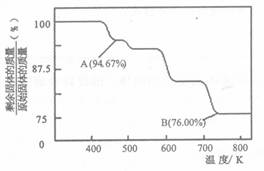
题目内容
下列四个图像的有关说法正确的是( )
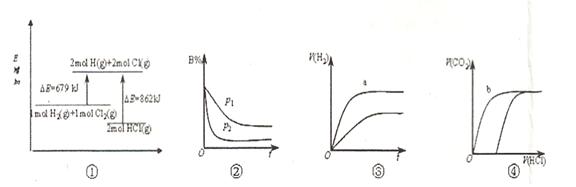

| A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ/mol |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
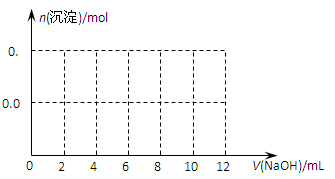
| D.④表示10mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.lmol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
C
试题分析:A不正确,该反应是放热反应,△H小于0;选项B中,根据图像可知,曲线P2德尔斜率大,所以P2大于P1,这说明压强越大,B的百分含量越小,即正反应是体积减小的反应,所以D一定不是气体,B不正确;醋酸是弱酸,在pH相等的条件下,醋酸的浓度大于盐酸的,反应速率快,C正确;碳酸钠和盐酸反应是分步进行的,所以b表示的是碳酸氢钠,D不正确,答案选C。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像 1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。 二、平衡图像 1.出现拐点的图像:分析依据“先拐先平” 。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。

练习册系列答案
相关题目
 2NH3(g) △H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)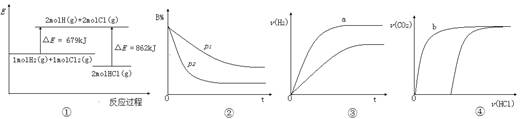
 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
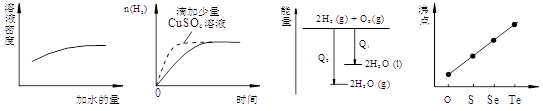
 的原料。已知:
的原料。已知:
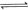



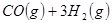




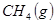 与
与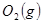 反应生成
反应生成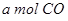 与
与 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: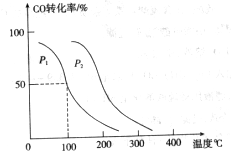

 (填“<”、“>”或“=”)
(填“<”、“>”或“=”) 、
、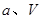 的代数式表示)。
的代数式表示)。 电极通入的
电极通入的 为 ,电极反应式是 。
为 ,电极反应式是 。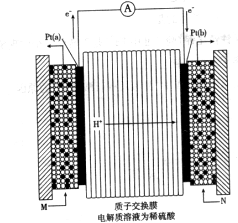
 溶液,当得到
溶液,当得到 铜时,参加反应的气体
铜时,参加反应的气体 的体积应为
的体积应为  (标准状况)。
(标准状况)。
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O