题目内容
8.下列说法正确的是( )| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO4) | |
| B. | 同浓度的下列溶液中,①NH4HSO4②NH4③NH3•H2O c(NH4+)由小到大的顺序是:②>①>③ | |
| C. | 0.1mol•L-1Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-C(OH-) | |
| D. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 |
分析 A.pH=5,说明HSO3中,HSO3-的电离大于水解,故c(SO32-)>c(H2SO3),而水解电离只是占了一小部分,故c(HSO3-)>c(SO32-)>c(H2SO3);
B.①NH4HSO4 溶液中的氢离子浓度对铵根离子水解起到抑制作用,②NH4Cl溶液中氯离子对铵根离子水解无影响,③NH3•H2O是弱电解质溶液中的铵根离子浓度一定小于①②溶液中的铵根离子浓度,据此判断溶液中铵根离子浓度c(NH4+)大小;
C.0.1 mol•L-1 Na2CO3溶液中存在电荷守恒和物料守恒,根据溶液中的物料守恒和电荷守恒分析;
D.混合后溶液中钠离子浓度为0.1mol/L,溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据电荷守恒可得:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1.
解答 解:A.pH=5的NaHSO3溶液呈酸性,说明亚硫酸氢根离子电离大于水解,溶液中离子浓度大小为:c(HSO3-)>c(SO32-)>c(H2SO3),故A正确;
B.同浓度的下列溶液中,①NH4HSO4 溶液中的氢离子浓度对铵根离子水解起到抑制作用,②NH4Cl溶液中氯离子对铵根离子水解无影响,③NH3•H2O是弱电解质溶液中的铵根离子浓度一定小于①②溶液中的铵根离子浓度,所以溶液中铵根离子浓度c(NH4+)由大到小的顺序为:①>②>③,故B错误;
C.0.1 mol•L-1 Na2CO3溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),合并消去钠离子浓度可得:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故C错误;
D.0.2 mol•L-1 CH3COOH溶液和0.2 mol•L-1 CH3COONa溶液等体积混合后,溶液中钠离子浓度为0.1mol/L,根据溶液中的电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可得:c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.1 mol•L-1,故D正确;
故选AD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小的方法.

| A. | 温度升高,c(H2PO4-)增大 | |
| B. | 加水稀释后,m(H+)与m(OH-)的乘积减少 | |
| C. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| D. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) |
反应历程为①O3═02+O(慢);②O3+O═2O2(快).下列说法正确的是:( )
| A. | 臭氧比氧气稳定 | B. | 臭氧分解的反应速率由步骤①决定 | ||
| C. | 反应的活化能等于285kJ•mol-1 | D. | 氧原子是该反应的催化剂 |
| A. | 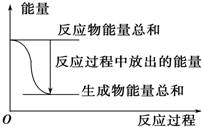 反应过程中能量关系可用如图表示 | |
| B. | △H的值与反应方程式的计量系数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| A. | 常温下都可用锌制容器贮存 | B. | 常温下都能与铜较快反应 | ||
| C. | 露置于空气中,溶液质量均减轻 | D. | 露置于空气中,溶液浓度均降低 |
| A. | 苯分子的模型示意图  | B. | -OH与 都表示羟基 都表示羟基 | ||
| C. | S2-的结构示意图:S2-  | D. | 次氯酸的结构式为:H-Cl-O |


 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.