题目内容
20.下列关于浓HNO3与浓H2SO4的叙述正确的是( )| A. | 常温下都可用锌制容器贮存 | B. | 常温下都能与铜较快反应 | ||
| C. | 露置于空气中,溶液质量均减轻 | D. | 露置于空气中,溶液浓度均降低 |
分析 A.常温下,浓硫酸和浓硝酸都能和Zn反应;
B.常温下,浓硫酸和Cu不反应;
C.浓硫酸具有吸水性、浓硝酸具有挥发性;
D.浓硫酸具有吸水性、浓硝酸具有挥发性.
解答 解:A.常温下,浓硫酸和浓硝酸都能和Zn反应生成锌盐,所以不能用锌制容器盛放浓硫酸、浓硝酸,常温下Fe和Al与浓硝酸、浓硫酸发生钝化现象,所以可以用铝或铁制容器盛放浓硫酸、浓硝酸,故A错误;
B.常温下,浓硫酸和Cu不反应,加热条件下铜和浓硫酸发生氧化还原反应,故B错误;
C.浓硫酸具有吸水性、浓硝酸具有挥发性,所以露置于空气中,浓硫酸质量增加、浓硝酸质量减少,故C错误;
D.浓硫酸具有吸水性、浓硝酸具有挥发性,所以浓硫酸中溶质不变、溶剂增加,浓度降低,浓硝酸中溶质减少、溶剂不变,则浓度降低,故D正确;
故选D.
点评 本题考查浓硫酸、浓硝酸的性质,侧重考查浓硫酸吸水性、浓硝酸的挥发性及二者强氧化性,知道钝化现象及原理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是( )
| A. | 该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl | |
| B. | 母液中通入的氨气与HCO3-反应:NH3+HCO3-→CO32-+NH4+ | |
| C. | 加食盐是为增大溶液中Cl-的浓度 | |
| D. | 由题可知温度较低时,氯化铵的溶解度比氯化钠的大 |
11.下列有关试剂的保存方法及性质描述错误的是( )
| A. | 常温下浓硫酸可以用铝罐储存,是因为铝能在冷的浓硫酸中钝化 | |
| B. | 氢氧化钠溶液保存在有橡皮塞的玻璃试剂瓶中 | |
| C. | 在蔗糖中滴加浓硫酸,蔗糖变黑是因为浓硫酸具有脱水性 | |
| D. | 浓硝酸保存在无色玻璃试剂瓶中 |
8.下列说法正确的是( )
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO4) | |
| B. | 同浓度的下列溶液中,①NH4HSO4②NH4③NH3•H2O c(NH4+)由小到大的顺序是:②>①>③ | |
| C. | 0.1mol•L-1Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-C(OH-) | |
| D. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 |
15.在面盆、痰盂等铁制品表面烧制搪瓷的目的是( )
| A. | 美观和杀菌消毒作用 | B. | 增大厚度防止磨损 | ||
| C. | 增大硬度防止撞坏 | D. | 防止铁生锈且美观 |
5.观察下列模型并结合有关信息,判断有关说法不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结 构 模 型 示 意 图 | 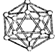 | 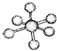 | 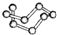 |  |
| 备注 | 熔点1873K | 易溶于CS2 |
| A. | 单质硼属于原子晶体,结构单元中含有30个B-B键,含有20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | HCN的结构式为H-C≡N |
12.某有机物A的分子式为C6H12O2,已知A~E有如图转化关系.则A的结构可能有( )
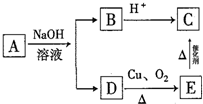

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
10.葡萄糖的分子式为C6H12O6,其中氧的质量分数为是( )
| A. | 33.3% | B. | 25.0% | C. | 50.0% | D. | 53.3% |
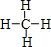 ,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.
,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.