题目内容
13.对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0的化学反应下列叙述不正确的是( )| A. | 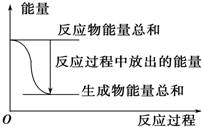 反应过程中能量关系可用如图表示 | |
| B. | △H的值与反应方程式的计量系数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
分析 对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0,反应为放热反应,则反应物的总能量大于生成物的总能量,当将该反应设计呈原电池时,Zn为负极,被氧化,正极上析出氢气,以此解答该题.
解答 解:A.反应为放热反应,则反应物的总能量大于生成物的总能量,图示正确,故A正确;
B.热化学方程式中,反应热与物质的物质的量呈正比,故B正确;
C.反应中Zn被氧化生成ZnSO4,当将该反应设计呈原电池时,Zn为负极,故C正确;
D.若将其设计为原电池,当有32.5g锌溶解时,转移电子1mol,则正极放出气体的体积在标况下为11.2L,未指明标况下就不一定为11.2 L,故D错误.
故选D.
点评 本题考查化学反应能量的变化,题目难度不大,本题注意反应热以及原电池的工作原理,学习中注意相关知识的理解和掌握.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
8.下列说法正确的是( )
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO4) | |
| B. | 同浓度的下列溶液中,①NH4HSO4②NH4③NH3•H2O c(NH4+)由小到大的顺序是:②>①>③ | |
| C. | 0.1mol•L-1Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-C(OH-) | |
| D. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 |
5.观察下列模型并结合有关信息,判断有关说法不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结 构 模 型 示 意 图 |  |  |  |  |
| 备注 | 熔点1873K | 易溶于CS2 |
| A. | 单质硼属于原子晶体,结构单元中含有30个B-B键,含有20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | HCN的结构式为H-C≡N |
2.下列叙述中错误的是( )
| A. | 点燃前甲烷不必验纯 | |
| B. | 甲烷燃烧能放出大量的热,所以是一种很好的气体燃料 | |
| C. | 煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生 | |
| D. | 甲烷是一种具有正四面体结构的很稳定的气体 |
3.部分弱酸的电离平衡常数如表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 等浓度的HCOONa和NaCN溶液的pH前者大于后者 | |
| D. | 中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者 |

 、取代反应
、取代反应 、加聚反应
、加聚反应