题目内容
15.铝与过量的稀盐酸反应,为了缓解反应速率,但是又不影响生产的氢气总量,下列采取措施能达到实验目的是( )| A. | 加入一定体积的NaCl溶液 | B. | 加入一定体积的KNO3饱和溶液 | ||
| C. | 加入少量的Na2CO3固体 | D. | 加入少量的CuSO4固体 |
分析 铝与过量的稀盐酸反应,为了缓解反应速率,但是又不影响生产的氢气总量,可以通过降低氢离子浓度、降低温度等方法实现,但加入的物质不能和稀盐酸反应,据此分析解答.
解答 解:A.加入移动体积的氯化钠溶液,氢离子浓度降低,且氯化钠和稀盐酸不反应,所以能实现目的,故A正确;
B.加入硝酸钾饱和溶液,氢离子浓度降低,但硝酸和Al反应生成氮氧化物,所以不能实现目的,故B错误;
C.碳酸钠和稀盐酸反应,所以影响氢气总量,故C错误;
D.加入少量硫酸铜固体,Al置换出Cu,Al、Cu和稀盐酸构成原电池而加速反应速率,故D错误;
故选A.
点评 本题考查化学反应速率影响因素,明确温度、压强、浓度、催化剂等对化学反应速率的影响原理即可解答,易错选项是B,注意硝酸和铝反应不生成氢气,为易错点.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
6.几种短周期元素的原子半径及主要化合价如下表:
根据以上信息,回答:
(1)写出四种元素的元素名称:X镁 Y铝 Z氮 W氧
(2)写出实验室制取Z的气态氢化物的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,常用向下排空气法(方法)来收集Z的气态氢化物.
(3)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O
(4)一定条件下,W单质可以将Z单质从其氢化物中置换出来,请写出其化学反应方程式:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
(1)写出四种元素的元素名称:X镁 Y铝 Z氮 W氧
(2)写出实验室制取Z的气态氢化物的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,常用向下排空气法(方法)来收集Z的气态氢化物.
(3)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O
(4)一定条件下,W单质可以将Z单质从其氢化物中置换出来,请写出其化学反应方程式:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
20.由两种短周期元素X和Y可组成化合物XY3,当X的原子序数为m时,Y的原子序数可能为( )
①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12.
①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12.
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①③④⑤⑥ | D. | ①②③④⑤⑥ |
7.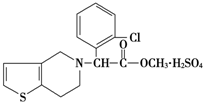 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )
 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质难溶于水 | |
| C. | 波立维能形成硫酸氢盐是与其结构中的氮原子有关 | |
| D. | 它可以与NaOH溶液反应,1 mol该物质最多可消耗2mol NaOH |
8.人生病时要合理用药.下列药品与其作用相匹配的是 ( )
| A. | 阿司匹林:消炎抗菌 | B. | 氢氧化铝:中和过多胃酸 | ||
| C. | 青霉素:解热镇痛 | D. | 医用碘酒:人体补碘 |
9.下列说法中正确的是( )
| A. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用Ca(OH)2鉴别NaHCO3溶液和饱和Na2CO3溶液 | |
| D. | 把100mL 3mol/L的硫酸与100mL H2O混合,硫酸的物质的量浓度变为1.5mol/L |
 .
.