题目内容
6.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
(1)写出四种元素的元素名称:X镁 Y铝 Z氮 W氧
(2)写出实验室制取Z的气态氢化物的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,常用向下排空气法(方法)来收集Z的气态氢化物.
(3)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O
(4)一定条件下,W单质可以将Z单质从其氢化物中置换出来,请写出其化学反应方程式:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
分析 短周期元素中,W的化合价为-2价,故W为O元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为N元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素相差大很多,可知X、Y位于第三周期相邻主族,故X为Mg元素,Y为Al元素,结合元素周期律与物质性质解答.
解答 解:短周期元素中,W的化合价为-2价,故W为O元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为N元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素相差大很多,可知X、Y位于第三周期相邻主族,故X为Mg元素,Y为Al元素.
(1)X为镁、Y为铝、Z为氮、W为氧,故答案为:镁;铝;氮;氧;
(2)Z的气态氢化物为氨气,实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,常用向下排空气法来收集,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;向下排空气法;
(3)Y、Z的最高价氧化物对应的水化物分别为Al(OH)3、HNO3,二者反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)一定条件下,氧气单质可以与氨气反应生成氮气与水,反应方程式为:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,
故答案为:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
点评 本题考查结构性质位置关系应用,难度中等,利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质.

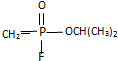 .已知
.已知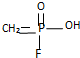 的名称为甲氟磷酸,则“沙林”的化学名称为( )
的名称为甲氟磷酸,则“沙林”的化学名称为( )| A. | 甲氟磷酸异丙醚 | B. | 甲氟磷酸异丙酯 | ||
| C. | 甲基异丙基氟磷酸 | D. | 甲氟异丙氧基磷酸 |
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为K>Na>Mg,这三种元素的最高价氧化物的水化物中,按碱性由强到弱顺序排列为KOH>NaOH>Mg(OH)2(用化学式表示);
(3)①对应元素名称为氧,在元素周期表中所处位置为第二周期ⅥA族其氢化物与③反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(4)⑤、⑥、⑦三种元素的最高价氧化物的水化物酸性由强到弱顺序排列为HClO4>H2SO4>H3PO4;②、⑦、⑩氢化物稳定性由强到弱顺序排列为HF>HCl>HBr(用化学式表示);
(5)③元素与⑦元素两者核电荷数之差是6.
| A. | 卤族元素从F到I,其气态氢化物的稳定性逐渐减弱,HX水溶液酸性逐渐增强 | |
| B. | 卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX的熔沸点:HF>HI>HBr>HCl | |
| D. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 |
| A. | 金刚石的网状结构中,最小的环上有6个碳原子 | |
| B. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 在氯化铯晶体中,每个氯离子周围最近且等距离的氯离子有8个 |
| A. | 加入一定体积的NaCl溶液 | B. | 加入一定体积的KNO3饱和溶液 | ||
| C. | 加入少量的Na2CO3固体 | D. | 加入少量的CuSO4固体 |
当0.5molK218O2与足量H2O完全反应后,下表对生成物O2的叙述中错误的是( )
| K218O2的质量 | O2的叙述 | |
| A | 57g | O2的质量是9g |
| B | 57g | 生成标准状况下O2的体积为5.6L |
| C | 57g | O2的摩尔质量是32g•mol-1 |
| D | 57g | 生成0.25mol O2 |
| A. | A | B. | B | C. | C | D. | D |
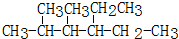
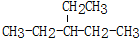 .
.