题目内容
3.在标准状况下22g CO2的体积是11.2L,与14g N2含有相同的分子数.分析 根据n=$\frac{m}{M}$计算二氧化碳物质的量,再根据V=nVm计算其体积;分子数相同,则物质的量相等,根据m=nM计算氮气的质量.
解答 解:22g CO2的物质的量为$\frac{22g}{44g/mol}$=0.5mol,标况下,二氧化碳体积是0.5mol×22.4L/mol=11.2L;
与N2含有相同的分子数,则氮气物质的量为0.5mol,其质量为0.5mol×28g/mol=14g,
故答案为:11.2;14.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算,侧重对基础知识的巩固.

练习册系列答案
相关题目
13.不洁净玻璃仪器洗涤方法正确的是( )
| A. | 做银镜反应后的试管用氨水洗涤 | |
| B. | 做碘升华实验后的烧杯用酒精洗涤 | |
| C. | 盛装苯酚后的试管用盐酸洗涤 | |
| D. | 收集完乙酸乙酯的试管用碳酸钠溶液洗涤 |
11.有关晶体结构的叙述中,错误的是( )
| A. | 金刚石的网状结构中,最小的环上有6个碳原子 | |
| B. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 在氯化铯晶体中,每个氯离子周围最近且等距离的氯离子有8个 |
8.下列说法正确的是( )
| A. | 用1L水里含有溶质物质的量来表示的浓度叫做物质的量浓度 | |
| B. | 用一定量溶液里含有溶质的多少来表示的浓度叫做物质的量浓度 | |
| C. | 用1L溶液里含有溶质的量来表示的浓度叫做物质的量浓度 | |
| D. | 用1L溶液里含有多少摩尔溶质来表示的浓度叫做物质的量浓度 |
15.铝与过量的稀盐酸反应,为了缓解反应速率,但是又不影响生产的氢气总量,下列采取措施能达到实验目的是( )
| A. | 加入一定体积的NaCl溶液 | B. | 加入一定体积的KNO3饱和溶液 | ||
| C. | 加入少量的Na2CO3固体 | D. | 加入少量的CuSO4固体 |
12.下表是第三周期部分主族元素的电离能数据:
下列说法不正确的是( )
| 元素 | I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 甲 | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
| 乙 | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
| 丙 | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16091 |
| 丁 | 1251.2 | 2298 | 3822 | 5158.6 | 6542 |
| A. | 甲的金属性比乙强,且甲和乙的最高价氧化物的水化物可以相互反应 | |
| B. | 乙的最外层电子轨道表达式: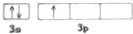 | |
| C. | 丙的最高价氧化物性质稳定,属于原子晶体,常温下不和强酸、强碱、强氧化剂反应 | |
| D. | 丁的常见的气态氢化物一定是极性分子 |
17.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,7.8 g 固体Na2O2中,含有的阴阳离子总数为0.4 NA | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6 g时,流过外电路的电子为0.3 NA | |
| D. | 4℃时,20 g 2H216O中含有共用电子对数为2 NA |
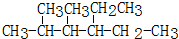
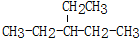 .
.