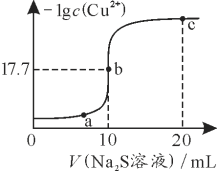
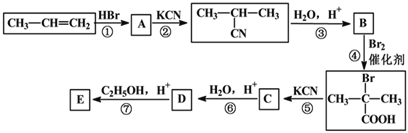
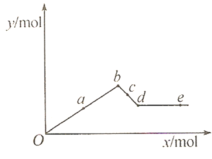
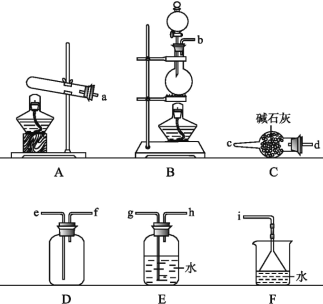
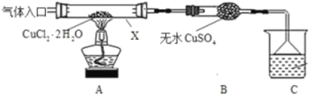
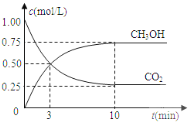
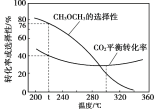
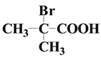题目内容
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
【答案】A
【解析】A、Zn(OH)2溶于水形成的饱和溶液中,令饱和溶液中锌离子浓度为x,x×(2x)2=1.0×10-18,x=![]() =6.3×10-7 mol·L-l, c(Zn2+)<1.0×10-6 mol·L-l,故A错误;B、HCOO-的水解常数为
=6.3×10-7 mol·L-l, c(Zn2+)<1.0×10-6 mol·L-l,故A错误;B、HCOO-的水解常数为![]() 1.0×10-10,故B正确;C、向Zn(OH)2悬浊液中加入HCOOH,溶液中氢氧根离子减小,溶解平衡正向移动,溶液中c(Zn2+)增大,故C正确;D、Zn(OH)2+2HCOOH
1.0×10-10,故B正确;C、向Zn(OH)2悬浊液中加入HCOOH,溶液中氢氧根离子减小,溶解平衡正向移动,溶液中c(Zn2+)增大,故C正确;D、Zn(OH)2+2HCOOH![]() Zn2++2HCOO-+2H2O的平衡常数K=
Zn2++2HCOO-+2H2O的平衡常数K=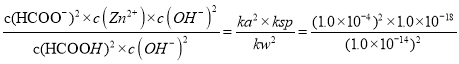 = 100,故D正确;故选A。
= 100,故D正确;故选A。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑧ | ⑩ | |||||
三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
四 | ② | ④ |
(1)在这10种元素中,化学性质最不活泼的元素是__(写序号),得电子能力最强的原子是___(用元素符号表示);元素⑦的最高价氧化物对应的水化物是___(写化学式)。
(2)元素④的离子结构示意图为__。③与⑧形成的化合物的电子式:___。
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示)___。
(4)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式:___。
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为___。
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为___。