题目内容
【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-
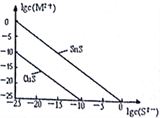
①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
【答案】 5 0.034 AC H2S+CO32-=HS-+HCO3- c(Na+)>c(HS-)>c(OH-) >c(H+))> c(S2-) 10-35 2.5×10-13
【解析】(1) ΔH=反应物断键吸收的总能量-生成物成键放出的总能量=1321+440-680-1076=5 kJ·mol-1;正确答案:5。
(2) COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始量 1 1 0 0
变化量 x x x x
平衡量 1-x 1- x x x
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量 x 1 0 1- x
变化量 y y y y
平衡量 x- y 1- y y 1- x+ y
根据题给信息可知:1-x=0.8, x=0.2 mol;反应后混合气体总量为1-x+x+x-y+1-y+y+1- x+y=3mol,根据CO的体积分数为4%列方程 (0.2-y)/3=0.04, y=0.08 mol; c(H2)=(1- x+ y)/10=0.088mol/L;c(H2S)= x /10=0.02mol/L;c(CO)= (x-y)/10=0.012 mol/L; c(COS)= (1-x)/10=0.08mol/L;反应I的平衡常数为c(CO)c(H2S)/ c(H2) c(COS)= 0.012×0.02/0.08×0.088=0.034;正确答案:0.034。
(3) 由于容器M的正反应为放热反应。随着反应的进行,反应的温度升高;由于恒容绝热,升高温度,平衡左移,两容器中CO的物质的量M>N,A正确;M中温度大于N中的温度,所以两容器中正反应速率M>N,B错误;容器M中反应是从正反应方向开始的,容器N中是反应是从逆反应方向开始的,由于恒容绝热(与外界没有热量交换),所以CO的转化率与容器Ⅱ中CO2的转化率之和必然小于1,C正确;容器M中反应是从正反应方向开始的,由于恒容绝热(与外界没有热量交换),平衡左移,所以两容器中反应的平衡常数M
(4)根据电离常数可以得知酸性顺序:H2CO3>H2S>HCO3->HS-;所以H2S与Na2CO3溶液反应生成NaHS和NaHCO3;正确答案:H2S+CO32-=HS-+HCO3-。设生成Na2S xmol和NaHS ymol,根据硫元素守恒:x+y=448×10-3/22.4 ;根据钠元素守恒:2x+y=0.1×0.2,解之x=0,y=0.02mol;所以100mL、0.2mol·L-1NaOH溶液恰好吸收448mL(标况)H2S气体生成NaHS,NaHS溶液电离大于水解过程,溶液显碱性,溶液中各离子浓度大小关系为:c(Na+)>c(HS-)>c(OH-) >c(H+))> c(S2-);正确答案:c(Na+)>c(HS-)>c(OH-) >c(H+))> c(S2-)。
(5)①在25℃时,CuS饱和溶液中存在沉淀溶解平衡:CuS(s)Cu2+(aq)+S2-(aq),Ksp(CuS)=c(Cu2+)×c(S2-)=10-25×10-10=10-35;正确答案:10-35。
②Ksp(SnS)= c(Sn2+)×c(S2-)=10-25×1=10-25>Ksp(CuS)=10-35,所以25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,Cu2+先沉淀完成后,
Sn2+开始沉淀;c(Sn2+)=(50×10-3×0.01)/(200×10-3)=2.5×10-3 mol·L-1;根据Ksp(SnS)=c(S2-)×2.5×10-3=10-25,c(S2-)=4×10-23 mol·L-1 ;根据Ksp(CuS)=c(Cu2+)×4×10-23=10-35,c(Cu2+)=2.5×10-13mol·L-1;正确答案:2.5×10-13。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】消毒剂在生产、生活中有重要的作用,常见的含氯消毒剂有NaClO2、NaClO、ClO2 和Cl2
回答下列问题:
(1)NaClO2所含的化学键类型有________________。
(2)消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是________________(用化学方程式表示)。
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是________________。
(4)自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
pH | 2 | 7 |
粒子种类 | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈___________(填“蓝色”或“无色”)
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=___________mg·L-1
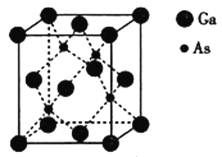
【题目】镓与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态Ga原子的核外电子排布式为__________,基态As原子核外有__________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__________和+3。砷的电负性比镓__________(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:__________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是_______________________________________。
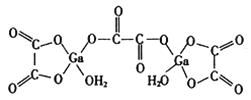
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为__________,草酸根中碳原子的杂化方式为__________。
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,该晶体的类型为__________,晶体的密度为__________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。