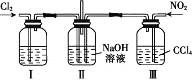
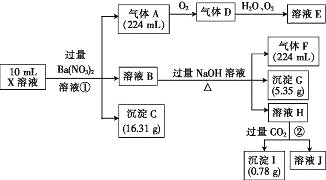
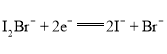题目内容
【题目】某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入0.1mol/L NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示,则下列说法正确的是

A.横坐标0—50mL 时,发生反应只有:Mg2++2OH-= Mg(OH)2↓Al3++3OH-= Al (OH)3↓
B.B点生成沉淀的质量为13.6g
C.若往C点的溶液中加入0.1mol/L 盐酸100 mL ,沉淀将全部溶解
D.H+、Mg2+、Al3+三种阳离子物质的量浓度之比为2:2:1
【答案】C
【解析】
根据图象知,横坐标为0-10mL时发生的反应是:H++OH-=H2O,加入10mLNaOH溶液结合中和氢离子,n(H+)=n(NaOH)=0.01L×0.1mol/L=0.001mol;横坐标为50-60mL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗消耗10mLNaOH溶液,由方程式可知n(Al3+)=n[Al(OH)3]=n(NaOH)=0.01L×0.1mol/L=0.001mol,根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.001mol;横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH-守恒,2n[Mg(OH)2]+3n[Al(OH)3] =n(NaOH)=0.1mol/mol×0.04,得n[Mg(OH)2]=n(Mg2+)=0.0005mol。
A. 由分析可知,横坐标为0-10mL时发生的反应是:H++OH-=H2O,横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓
,故A错误;
B. 由分析可知:n[Mg(OH)2]=n(Mg2+)=0.0005mol,n(Al3+)=n[Al(OH)3]=0.001mol,B点生成沉淀的质量为78g/mol×0.001mol+58g/mol×0.0005mol=0.107g,故B错误;
C. C点时剩余Mg(OH)2沉淀,物质的量为0.0005mol,加入0.1mol/L 盐酸100 mL,盐酸过量,沉淀将会完全溶解,故C正确;
D. 由分析可知n(H+)=0.001mol,n(Mg2+)=0.0005mol,n(Al3+)=0.001mol,H+、Mg2+、Al3+三种阳离子物质的量浓度之比为2:1:2,故D错误;
正确答案是C。

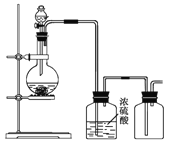
【题目】Ⅰ.课堂上,老师提问如何鉴别浓硫酸与稀硫酸,某学习小组设计方案如下
方案 | 结论 | |
① | 往酸中投入火柴梗 | 变黑者为浓硫酸 |
② | 加入铝片 | 产生刺激性气味者为浓硫酸 |
② | 加少量酸于盛水的小烧杯中 | 放热者为浓硫酸 |
④ | 用玻璃棒蘸浓氨水靠近酸的瓶口 | 冒白烟者为浓硫酸 |
⑤ | 将酸滴加到胆矾晶体上 | 变白者为浓硫酸 |
(1)以上方案中,可行的是______________(填序号)
(2)其中一个稍作改进就能成为可行方案是________________,改进方法为____________。
(3)完全错误的是__________,因为_________________________________________。
Ⅱ.实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
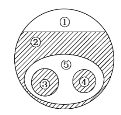
(1)如下图所示的仪器中配制溶液肯定不需要的是____________(填字母),配制上述溶液还需要用到的玻璃仪器是_________________________(填仪器名称)。

(2)容量瓶上标有以下5项中的_____________(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是______________(填序号)。
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为_____________________mL。(保留小数点后一位)