题目内容
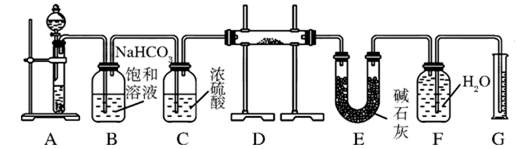
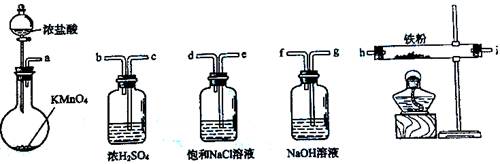
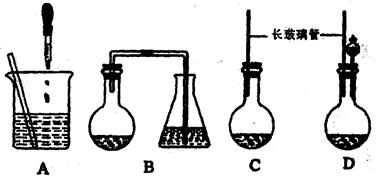
现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
请回答下列问题:
(1) 装置A中的液体试剂选用 ,理由是 ;
(2) 装置B的作用是 ,装置E中碱石灰的作用是 ;
(3) 装置D中发生反应的化学方程式是:
、 ;
(4) 若开始时测得样品的质量为2.0 g,反应结束后测得生成气体的体积为224 mL(标准状况),请计算出试样中Na2O2的纯度,要求写出计算过程。

请回答下列问题:
(1) 装置A中的液体试剂选用 ,理由是 ;
(2) 装置B的作用是 ,装置E中碱石灰的作用是 ;
(3) 装置D中发生反应的化学方程式是:
、 ;
(4) 若开始时测得样品的质量为2.0 g,反应结束后测得生成气体的体积为224 mL(标准状况),请计算出试样中Na2O2的纯度,要求写出计算过程。
(1) 6 mol/L盐酸(1分)
硫酸与CaCO3反应生成微溶的CaSO4,覆盖在CaCO3表面,使反应终止。(1分)
(2) 除去气体中的HCl(1分) 吸收未反应的CO2(1分)
(3) 2Na2O2+2CO2===2Na2CO3+O2(2分)、 Na2O+CO2===Na2CO3(2分)
(4)试样中Na2O2的纯度为78% 。
试题分析:(1)装置A是为了制备二氧化碳,硫酸无法和碳酸钙反应生成硫酸钙,因为硫酸钙的溶解度大于碳酸钙,硫酸与CaCO3反应生成微溶的CaSO4,覆盖在CaCO3表面,使反应终止。所以选择盐酸。(2)除去盐酸防止它与过氧化钠反应。吸收未反应完的二氧化碳,最后只计算氧气的体积。(3)D中是二氧化碳接触过氧化钠反应的过程,其中二氧化碳也与杂质氧化钠反应,方程式有两个。
(4)解:设试样中Na2O2的质量为χg,依题意可知:
2Na2O2+2CO2===2Na2CO3+O2
2×78 22.4 L
χ 0.224 L
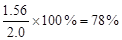
解得χ="1.56"
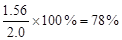
点评:本题涉及到了过氧化钠与二氧化碳反应的实验,其中二氧化碳的制备反应以及装置在初中已经学过,难度不高。各个实验装置的作用需要学生从除杂方面考虑。最后关于物质的量的计算,可以直接根据方程式计算,难度不高。

练习册系列答案
相关题目

 Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。
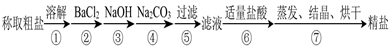
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):