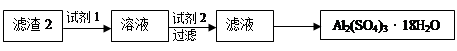题目内容
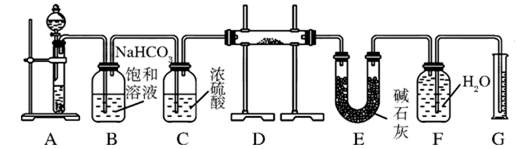
(12分)为除去粗盐中的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
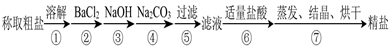
(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是_____________、______________。
(2)判断BaCl2已过量的方法是_____________________________________________________。
(3)第④步中,相关的离子方程式是________________________________________________。
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是____________________________。
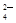 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是_____________、______________。
(2)判断BaCl2已过量的方法是_____________________________________________________。
(3)第④步中,相关的离子方程式是________________________________________________。
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是____________________________。
(1)搅拌,加速固体溶解 ;引流 。
(2)取上层清液,继续加BaCl2,无沉淀产生 。
(3)Ca2++CO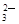 =CaCO3↓、Ba2++CO
=CaCO3↓、Ba2++CO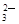 =BaCO3↓ 。
=BaCO3↓ 。
(4)若过滤前加盐酸,前面所生成的沉淀会被盐酸溶液重新变为离子进入溶液。
(2)取上层清液,继续加BaCl2,无沉淀产生 。
(3)Ca2++CO
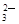 =CaCO3↓、Ba2++CO
=CaCO3↓、Ba2++CO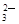 =BaCO3↓ 。
=BaCO3↓ 。(4)若过滤前加盐酸,前面所生成的沉淀会被盐酸溶液重新变为离子进入溶液。
试题分析:(1)在第①步,玻璃棒作用是搅拌,加速固体溶解;第⑤步在过滤操作玻璃棒的作用是引流。(2)取上层清液,继续加BaCl2,无沉淀产生,说明BaCl2已过量。另外判断BaCl2已过量也可以看Ba2+是不是过量,即是取上层清液,加入少量稀硫酸,有沉淀产生。(3)在第②步中除去SO42-,在第③步中除去Mg2+,所以第④步中除去Ca2+及过量的Ba2+,所以Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓. (4)若过滤前加盐酸, CaCO3和BaCO3会与盐酸反应,又形成Ca2+和Ba2+进入溶液。
点评:考查了化学实验的一些基本操作,以及除杂加入试剂的顺序,和离子方程式的书写,都是高考化工流程题的常见考点。

练习册系列答案
相关题目