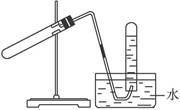
题目内容
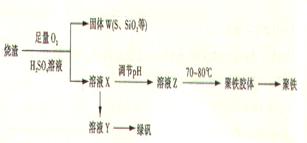
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如表所示。回答下列问题:

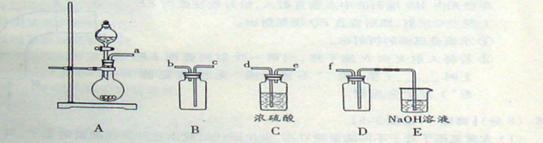
(1)图中“试剂1”为 。
(2)加入CuO作用是调节溶液pH,则pH的范围为 。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通人饱和食盐水中。其中,应先通入气体是 (填物质的化学式)
(4)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O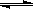 Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。

(1)图中“试剂1”为 。
(2)加入CuO作用是调节溶液pH,则pH的范围为 。
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(4)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O
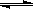 Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。(8分)(1)C12或H2O2 (1分)(2)3.2,4.7 (2分)
(3) NH3 (1分)(4)蒸发浓缩、(1分)冷却结晶 (1分) (5)5×10-9(2分)
(3) NH3 (1分)(4)蒸发浓缩、(1分)冷却结晶 (1分) (5)5×10-9(2分)
试题分析:由于Fe2+沉淀为Fe(OH)2的pH值与Cu2+沉淀为Cu(OH)2的pH较大,而与Fe3+沉淀为Fe(OH)3的pH相差较大,所以可以通过先将Fe2+氧化为Fe3+,再调节溶液的pH使铁以Fe(OH)3沉淀形式而被除去。为了使加入的氧化剂不带入新的杂质,显然用H2O2最好。出于同样的考虑,加入y调节溶液pH值时,应选用能与H+反应,而溶解度较小的物质如CuO为好,CuO稍多不会带入新杂质也不会使pH值升高太多而使Cu2+沉淀。
(1)由于亚铁离子沉淀时的pH值大于铜离子沉淀时的pH值,所以应该首先把亚铁离子氧化生成铁离子,然后在沉淀氢氧化铁即可,所以试剂1是氯水或双氧水。
(2)根据表中的数据可知,pH的范围为3.2≤pH<4.7。
(3)气体E是二氧化碳,F是氨气。由于二氧化碳的溶解度小,而氨气极易溶于水,所以首先通入的是氨气。
(4)由溶液C获得CuCl2·3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作。
(5)根据反应式可知K=
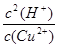 ,则K=
,则K=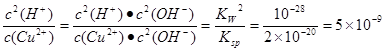 。
。点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固与训练,有利于培养学生规范、严谨的实验设计能力,提升学生的学科素养。该类试题需要注意的是该题需要明确的这种类型的试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目