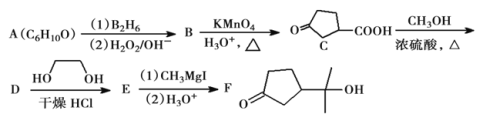
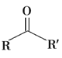
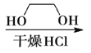
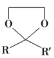
题目内容
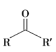
【题目】H2A为二元弱酸,常温下,向一定体积的0.1 mol·L-1的H2A溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2A、HA-、A2- )的物质的量分数a(X)随pH的变化曲线如图所示,![]()
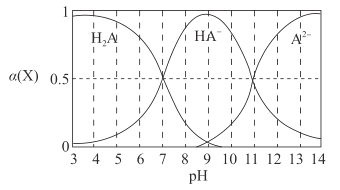
下列说法错误的是
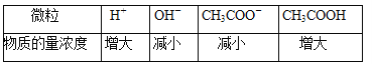
A.K1(H2A)=1.0×10 -7B.K2(H2A)=1.0×10-11
C.pH=9时,c(Na+ )<c(HA- )+ 2c(H2A)D.pH=7时,c(Na+ )=c(H2A)+2c(A2- )
【答案】C
【解析】
A. 电离平衡常数只受温度的影响,与浓度大小无关,Ka1=![]() ,由图可知,当pH=7时,c(H2A)=c(HA-),Ka1=c(H+)=10-7,故A说法正确;
,由图可知,当pH=7时,c(H2A)=c(HA-),Ka1=c(H+)=10-7,故A说法正确;
B. 根据A选项分析,pH=11时,c(A2-)=c(HA-),Ka2=c(H+)=10-11,故B说法正确;
C. 根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),pH=9的溶液显碱性,c(H+)<c(OH-),即c(Na+)>c(HA-)+2c(A2-),由图像可知,pH=9时, c(A2-)=c(H2A),代入表达式,c(Na+)>c(HA-)+2c(H2A),故C说法错误;
D. 根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),pH=7时,c(H+)=c(OH-),c(H2A)=c(HA-),得出c(Na+)= c(H2A)+2c(A2-),故D说法正确;
答案:C。

练习册系列答案
相关题目