题目内容
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣l
C(s)+O2(g)=CO2(g) △H=﹣393.5kJmol﹣l
2C(s)+O 2(g)=2CO(g) △H=﹣221kJmol﹣l
若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式__________________________________________________________。
,请写出此反应的热化学方程式__________________________________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g)。若在恒容绝热的密闭容器中充入一定量 N2O5进行该反应,下列选项能判断该反应达到平衡状态的是_______。
4NO2(g)+O2(g)。若在恒容绝热的密闭容器中充入一定量 N2O5进行该反应,下列选项能判断该反应达到平衡状态的是_______。
A.v 正(N2O5)=2v 逆(NO2) B.容器内NO2浓度是O2浓度的4倍
C.平衡常数K不再随时间而变化 D.混合气体的密度保持不变
E.混合气体的压强不随时间而变化
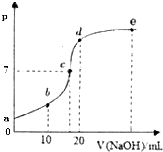
(3)工业上也可以利用I2O5消除CO的污染。已知:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的4L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间变化的曲线如下图。回答下列问题:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的4L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间变化的曲线如下图。回答下列问题:

①下列说法正确的是______________
A.d点时,增大体系压强,CO的转化率变大
B.T2时,0~2.0min内的反应速率v(CO)=0.6molL﹣lmin﹣l
C.b点时,向平衡体系中再加入I2O5(s),平衡向正反应方向移动
D.c点时体系中混合气体的压强在T2温度下更大
②5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)△H=_________0(填“>”、“=“、“<“),判断理由是______________________________________________。
5CO2(g)+I2(s)△H=_________0(填“>”、“=“、“<“),判断理由是______________________________________________。
(4)N2O4与 NO2之间存在反应:N2O4(g)![]() 2NO2(g)△H=QkJmol﹣l.将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如下图所示.如图 中 a 点对应温度下,已知 N2O4的起始压强 p0为 200kPa,该温度下反应的平衡常数的计算表达式Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2NO2(g)△H=QkJmol﹣l.将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如下图所示.如图 中 a 点对应温度下,已知 N2O4的起始压强 p0为 200kPa,该温度下反应的平衡常数的计算表达式Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.5kJmolˉ1 CE D < 由图可知T2>T1,温度升高CO2体积分数减小,平衡逆向移动,升高温度,平衡向吸热的方向移动,正向为放热反应 213.3KPa
【解析】(1)若某反应的平衡常数表达式为:K=![]() ,则反应为:2NO(g)+2CO(g)N2(g)+2CO2(g)
,则反应为:2NO(g)+2CO(g)N2(g)+2CO2(g)
又①N2(g)+O2(g)=2NO(g)△H=+180.5kJmoll
②C(s)+O2(g)=CO2(g)△H=393.5kJmoll
③2C(s)+O2(g)=2CO(g)△H=221kJmoll
盖斯定律计算②×2③①得到2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=746.5kJmolˉ1,
故答案为:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=746.5kJmolˉ1;
(2)A.N2O5与NO2的速率关系为:2v正(N2O5)=v逆(NO2),而不是v 正(N2O5)=2v 逆(NO2)A项错误;B. 容器内NO2浓度是O2浓度的4倍,不能确定反应是否达到化学平衡状态,B项错误;C. 平衡常数K仅与温度有关,所以平衡常数K不再随时间而变化,则说明温度不变,又恒容绝热,所以反应已达到化学平衡状态,C项正确;D. 反应前后质量不变,体积不变,所以混合气体的密度一直保持不变,则不能确定反应达到化学平衡状态,D项错误;E. 混合气体的压强不随时间而变化,反应已达到化学平衡状态,E项正确;故答案为:CE;
(3)①A. 对于给定的反应前后气体物质的量不变,增大压强平衡不移动,A项错误;B. 化学反应速率v=![]() =0.3molLlmin1,B项错误;C. 加入固体,平衡不移动,C项错误;D. 根据先拐先平衡知,T2比T1高,此时混合气体的压强更大,D项正确;答案选D;
=0.3molLlmin1,B项错误;C. 加入固体,平衡不移动,C项错误;D. 根据先拐先平衡知,T2比T1高,此时混合气体的压强更大,D项正确;答案选D;
②由图可知T2>T1,温度升高CO2体积分数减小,平衡逆向移动,升高温度,平衡向吸热的方向移动,正向为放热反应 ,故答案为:<;由图可知T2>T1,温度升高CO2体积分数减小,平衡逆向移动,升高温度,平衡向吸热的方向移动,正向为放热反应;
(4)四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x0.4x+0.8x)mol=1.4xmol,相同条件下气体的压强之比等于其物质的量之比,所以反应后压强=200KPa![]() 1.4xmol=280xKPa,四氧化二氮的分压=
1.4xmol=280xKPa,四氧化二氮的分压=![]() =120KPa,二氧化氮的分压=
=120KPa,二氧化氮的分压=![]() =160KPa,化学平衡常数K=生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积=1602
=160KPa,化学平衡常数K=生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积=1602![]() 120=213.3KPa,故答案为:213.3KPa;
120=213.3KPa,故答案为:213.3KPa;

 口算能手系列答案
口算能手系列答案