��Ŀ����
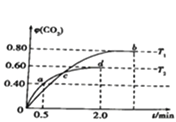
����Ŀ��25��ʱ����20mLŨ��Ϊ0.1mol/L��CH3COOH��Һ����μ���0.1mol/L��NaOH��Һ����ҺpH�ı仯��ͼ��ʾ������˵������ȷ���ǣ� ��
A.c��ʱ��c��Na+��=c��CH3COO����
B.b��ʱ��c��Na+����c��CH3COO������c��H+����c��OH����
C.d��ʱ��c��Na+����c��CH3COO������c��OH������c��H+��
D.��a�㵽c�������У�c��CH3COO������c��H+��=c��Na+����c��OH����
���𰸡�B
���������⣺A��������������Ʒ�Ӧ���ɴ����ƣ�c����Һ������c��H+��=c��OH���������ݵ���غ㣬��Na+��=c��CH3COO��������A��ȷ��
B��b��ʱ���õ�����Һ�Ǵ���ʹ����ƵĻ�����Һ��ʾ���ԣ�c��CH3COO������c��Na+����c��H+����c��OH��������B����
C��d��ʱ������ʹ�����ǡ����ȫ��Ӧ���õ����Ǵ����ƵĻ�����ʾ���ԣ���ʱ��c��Na+����c��CH3COO������c��OH������c��H+������C��ȷ��
D����a�㵽c����Ǵ�����������ӣ�ֱ��c�㣬��Ӧ��ɺ����ʣ����Һ��ʾ���ԵĹ��̣����Դ��ڣ�c��CH3COO������c��H+��=c��Na+����c��OH��������D��ȷ��
��ѡB��

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�����Ŀ���������ʷ������ȷ�����(����)
ѡ�� | �� | �� | �� | ���������� |
A | ���� | ���� | ���� | �������� |
B | �ռ� | ���� | ʳ�� | һ����̼ |
C | ������ | ���� | ʯ��ʯ | ˮ |
D | ������ | ̼�� | ̼��þ | �������� |
A.AB.BC.CD.D