题目内容
【题目】氮可以形成多种离子和分子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+中共价键的类型除极性键,非极性键外再写出一种__________。
(2)下列关于NH2-的说法合理的是____________________(填字母)。
A.H-N-H夹角109.5° B. H-N-H夹角180° C. H-N-H夹角大约105°
D.中心原子的杂化轨道为四面体形 E. 该离子为V形 F.易与H+结合
(3)写出N3-的等电子体且是中性分子的化学式___________________(一种)。
(4)N2H4名称是肼,也叫联氨,通常为无色油状发烟液体,有吸湿性,有氨的臭味。可作为火箭的燃料。其沸点比氨气高的主要原因是________________________。
利用含N的铜萃取剂M可通过如下反应实现铜离子的富集:
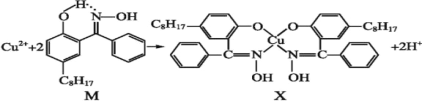
(5)X难溶于水、易溶于有机溶剂,X中配位原子是______。
(6)M中氮原子以_______杂化轨道与氧原子形成σ键。
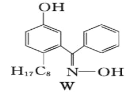
(7)M与W(如图)是同分异构体,则在水中溶解度较大的物质是___(填字母M或W)。
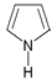
(8)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
【答案】 配位键或δ键 CDEF CO2或N2O 两者都是分子晶体,肼分子间氢键数目比氨分子多,分子间作用力大,沸点更高 N、O或N、O2- sp2 W ![]()
【解析】
(1)N2H62+是由N2H4结合质子形成的,因此N2H62+中共价键的类型除极性键,非极性键外还有配位键或δ键。
(2)NH2-与H2O互为等电子体,二者的结构与性质相似,则根据水分子的结构与性质可判断H-N-H夹角大约105°,中心原子的杂化轨道为四面体形,其空间构型为V形,易与H+结合,答案选CDEF;
(3)原子数和价电子数分别都相等的互为等电子体,则与N3-的等电子体且是中性分子的物质为CO2或N2O;
(4)由于两者都是分子晶体,肼分子间氢键数目比氨分子多,分子间作用力大,沸点更高,所以其沸点比氨气高;
(5)由于氧原子和氮原子均含有孤对电子,则X中配位原子是N和O;
(6)由结构简式可知N原子共形成3对共价键,1个配位键,即N原子采取sp2杂化;
(7)由于M能形成分子内氢键,使溶解度减小,而W能形成分子间氢键,则在水中溶解度较大的物质是W;
(8)根据结构简式可知吡咯环中的大π键是由5个原子提供6个电子形成的,则形成的π键可表示为![]() 。
。

【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)=2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A. 升高温度,反应速率加快
B. 增大压强,反应速率变慢
C. 在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
D. 若进入反应塔的混合气体为amol,反应速率以v=△n/△t表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s