题目内容
【题目】草酸亚铁晶体(化学组成为FeC2O4·2H2O)是一种淡黄色晶体粉末,是生产锂电池的原材料。已知FeC2O4·2H2O在300 ℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物。某学习小组欲验证草酸亚铁晶体的分解产物。
I.甲组同学设计了如下实验装置:

(1)实验开始前,鼓入氮气排出空气的目的是_____________________________。
(2)检验水和二氧化碳的装置分别是_______和_______。
(3)设计实验验证装置A中黑色残留物不含有Fe3O4_______________________________________________________________(简要说明实验操作,现象和结论)。
II.乙组同学选用甲组实验中的装置A(接口用x表示)和下图所示的装置(可以重复选用)验证分解产物CO。
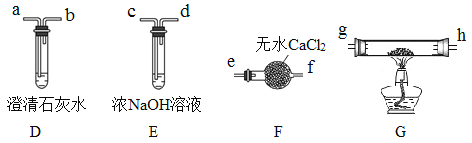
(4)乙组同学的实验装置中,依次连接的合理顺序为x→______g→h→a(用接口字母和“→”表示)。装置G反应管中盛有的物质是氧化铜。能证明草酸晶体分解产物中有CO的现象是___________。
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是________________________。
【答案】避免生成的FeO被氧化 B C 取少量装置A中固体残留物于试管中,加入稀硫酸溶解,然后滴加KSCN溶液,溶液不显红色,说明固体残留物中不含有Fe3O4 c→d→a→b→e→f G中的粉末由黑色变为红色,其后的D中的石灰水变浑浊 未对尾气进行处理,可造成环境污染
【解析】
本题主要考查验证草酸亚铁晶体的分解产物的探究实验。
I.(1)实验开始前,鼓入氮气排出空气的目的是避免生成的FeO被氧化。
(2)检验水和二氧化碳的装置分别是B和C。
(3)设计实验验证装置A中黑色残留物不含有Fe3O4,因为Fe3O4+8H+![]() 2Fe3++ Fe2++4H2O,所以可以检验Fe3+:取少量装置A中固体残留物于试管中,加入稀硫酸溶解,然后滴加KSCN溶液,溶液不显红色,说明固体残留物中不含有Fe3O4。
2Fe3++ Fe2++4H2O,所以可以检验Fe3+:取少量装置A中固体残留物于试管中,加入稀硫酸溶解,然后滴加KSCN溶液,溶液不显红色,说明固体残留物中不含有Fe3O4。
II.(4)乙组同学的实验装置中,通过E除去CO2,再通过D确认,最后通过F干燥气体,所以依次连接的合理顺序为x→c→d→a→b→e→f →g→h→a。装置G反应管中盛有的物质是氧化铜。能证明草酸晶体分解产物中有CO的现象是G中的粉末由黑色变为红色,其后的D中的石灰水变浑浊。
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是未对尾气进行处理,可造成环境污染

 阅读快车系列答案
阅读快车系列答案