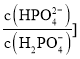题目内容
【题目】氢能被视为21世纪最具发展潜力的清洁能源。
(1)水是制取H2的常见原料,下列有关水的说法正确的是______.
a.水分子是一种极性分子,水分子空间结构呈直线型
b.1个H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H﹣O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键。
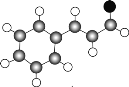
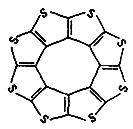
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为______,C16S8中σ键与π键之比为______,C16S8与H2微粒间的作用力是______。
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(用“→”表示)的氨硼烷的结构式_____;与氨硼烷互为等电子体的有机小分子是___(写结构简式)。
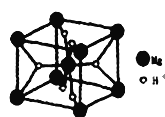
③某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进人到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图)的结构相似,该晶体储氢后Cu:Au:H为______。

④MgH2是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为______________cm3(用含a、NA的代数式表示,NA表示阿伏伽德罗常数)。
【答案】b sp2 4:1 范德华力 ![]() CH3CH3 3:1:8
CH3CH3 3:1:8 ![]()
【解析】
(1)a.H2O中H、O元素形成的极性键,分子空间结构呈V型,正负电荷中心不重合,属于极性分子;
b.H2O分子中2个氢原子的2个s轨道电子与氧原子的sp3杂化轨道的电子形成σ键;
c.水分子之间是通过氢键作用形成冰晶体;
d.根据冰晶胞与干冰晶胞的结构分析;
(2)①对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断,当n=2,sp杂化,n=3,sp2杂化,n=4,sp3杂化;结合物质的分子结合判断σ键、π键数目,可得到二者的比值;分子与分子间的作用力为分子间作用力;
②根据氮原子提供一对共用电子对给硼原子形成配位键;根据等电子体具有相同的电子数目和原子数目来分析;
③结合CaF2的结构图示,利用均摊法计算;
④先根据均摊法确定该晶胞中含有的各种原子个数,从而得出其质量,再根据V=![]() 计算其体积。
计算其体积。
(1)a.H2O分子空间结构呈V型,正负电荷中心不重合,属于极性分子,a错误;
b.H2O分子中2个氢原子的2个s轨道电子与氧原子的sp3杂化轨道形成σ键,b正确;
c.水形成冰晶体是通过氢键作用的,不是H-O键,c错误;
d.冰晶胞中水分子的空间排列方式与干冰晶胞中CO2的排列方式不同,d错误;
故合理选项是b;
(2)①根据图2结构可知:碳原子形成2个C-S,1个C=S二键,C原子杂化轨道数为2+1=3,C原子采取sp2杂化方式;
在C16S8中σ键数目为32,π键数目为8,所以C16S8中σ键与π键之比为32:8=4:1。C16S8分子与H2分子之间作用力是分子间作用力,分子间作用力也叫范德华力;
②氮原子提供一对共用电子对给硼原子形成配位键,氨硼烷的结构式为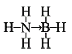 ,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3;
,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3;
③根据CaF2的结构图,结合题意可知,该晶胞中铜原子个数=6×![]() =3,金原子个数=8×
=3,金原子个数=8×![]() =1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,则该晶体储氢后Cu:Au:H为3:1:8;
=1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,则该晶体储氢后Cu:Au:H为3:1:8;
④该晶胞中镁原子个数=8×![]() +1=2,氢原子个数=4×
+1=2,氢原子个数=4×![]() +2=4,即含有2个MgH2,体积V=
+2=4,即含有2个MgH2,体积V=![]() =
=![]() cm3。
cm3。

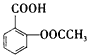
【题目】乙二酸俗称草酸![]() 结构简式为
结构简式为![]() ,可简写为
,可简写为![]() ,它是一种重要的化工原料.
,它是一种重要的化工原料.![]() 常温下
常温下![]() 的
的![]() 、
、![]() 、
、![]() 溶液的pH如表所示.
溶液的pH如表所示.![]()
|
|
| |
pH |
|
|
|
填空:
![]() 写出
写出![]() 的电离方程式______.
的电离方程式______.
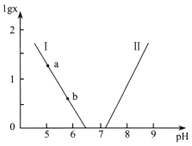
![]() 溶液显酸性的原因是______;向
溶液显酸性的原因是______;向![]() 的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.![]()
![]()
![]()
![]()
![]() 与酸性高锰酸钾溶液反应,现象是有气泡
与酸性高锰酸钾溶液反应,现象是有气泡![]() 产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
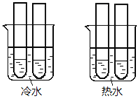
![]() 某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL
某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL![]()
![]()
![]() 溶液和4mL
溶液和4mL![]() 酸性
酸性![]() 溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
![]() 已知草酸
已知草酸![]() 受热分解的化学方程式为:
受热分解的化学方程式为:![]() ,写出
,写出![]() 在密闭容器中高温分解的化学方程式______.
在密闭容器中高温分解的化学方程式______.