题目内容
【题目】25℃时,将0.0l mol L -1 NaOH溶液滴入20mL0.01mol·L-1CH3COOH溶液的过程中,溶液中由水电离出的c(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是
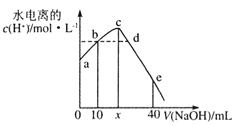
A. x=20,a点的纵坐标为1.0×10-12
B. b点和d点所示溶液的pH相等
C. 滴定过程中,c(CH3COO-)与c(OH-)的比值逐渐增大
D. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)
【答案】D
【解析】A、a点是0.01mol·L-1CH3COOH,电离出的H+ 浓度小于0.01mol·L-1,a点水电离的H+ 大于1.0×10-12,x<20ml,故A错误;B、b点酸性和d点显碱性,所示溶液的pH不相等,故B错误;C、滴定过程中,不断地加碱,c(OH-)一直增大,c(CH3COO-)与c(OH-)的比值逐渐减小, 故C错误;D、e点所示溶液中,醋酸的量是NaOH的2倍,由物料守恒可得c(Na+)=2c(CH3COO-)+2c(CH3COOH),故D正确;故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目