题目内容
【题目】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
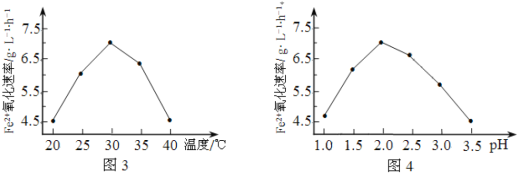
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
【答案】(14分)
(1)降低反应活化能(或作催化剂)
(2)30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性)
(3)H2SO4
(4)2OH-+ SO2![]() SO32-+H2O
SO32-+H2O
SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成
(5)6.0×10-3 0.62
【解析】
(1)根据硫杆菌存在时的反应速率可知,硫杆菌的作用是作催化剂,降低了反应的活化能。
(2)根据图3可知,温度30℃左右时,氧化速率最大,根据图4可知,pH=2.0时氧化速率最大,所以使用硫杆菌的最佳条件为30℃、pH=2.0;若反应温度过高,硫杆菌蛋白质变性失去活性造成反应速率下降。
(3)根据化合价升降,当n(H2O2)/n(H2S)=4时,4mol H2O2转移8mol电子,则1mol H2S也转移8mol电子,化合价从-2价升高到+6价,所以氧化产物为H2SO4。
(4)过程①是NaOH与SO2的反应,反应的离子方程式为2OH-+ SO2![]() SO32-+H2O;根据CaO在水中的转化:CaO(s)+ H2O (l)
SO32-+H2O;根据CaO在水中的转化:CaO(s)+ H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq),过程②中Na2SO3加入CaO后,SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成。
Ca2+(aq)+2OH(aq),过程②中Na2SO3加入CaO后,SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成。
(5)根据NH3·H2O的Kb=1.8×105可知, =1.8×105,当氨水的浓度为2.0 mol·L-1时,溶液中的c(OH)= c(NH4+)=6.0×10-3。
根据H2SO3的Ka2=6.2×108可知, =6.2×108,,当c(OH)降至1.0×107 mol·L1,溶液中的c(SO32-)/c(HSO3-)=0.62。