题目内容
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
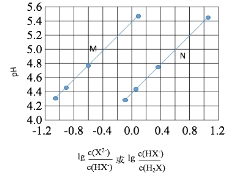
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
【答案】D
【解析】A、Ka2=![]() ,己二酸是弱酸,第二步电离小于第一步,曲线M是己二酸的第二步电离,根据图像,取-0.6和4.8点,
,己二酸是弱酸,第二步电离小于第一步,曲线M是己二酸的第二步电离,根据图像,取-0.6和4.8点,![]() =10-0.6mol·L-1,c(H+)=10-4.8mol·L-1,代入Ka2,得到Ka2=10-5.4=10-6+0.6=100.6*10-6=3.98*10-6,A正确;B.当
=10-0.6mol·L-1,c(H+)=10-4.8mol·L-1,代入Ka2,得到Ka2=10-5.4=10-6+0.6=100.6*10-6=3.98*10-6,A正确;B.当![]() =0或lg
=0或lg![]() =0,溶液中c(H2X)=c(HX-),c(X2-)=c(HX-),溶液中c(H2X)=c(HX-)时溶液的酸性强,即pH小,则曲线N表示pH与
=0,溶液中c(H2X)=c(HX-),c(X2-)=c(HX-),溶液中c(H2X)=c(HX-)时溶液的酸性强,即pH小,则曲线N表示pH与![]() 的关系,B正确;C.在NaHX溶液中,此时lg
的关系,B正确;C.在NaHX溶液中,此时lg![]() <0,溶液显酸性,即c(H+)>c(OH-),C正确;D.当混合溶液呈中性时,c(H+)=c(OH-),lg
<0,溶液显酸性,即c(H+)>c(OH-),C正确;D.当混合溶液呈中性时,c(H+)=c(OH-),lg![]() >1,即c(X2-)>c(HX-),D错误;答案选D。
>1,即c(X2-)>c(HX-),D错误;答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
【题目】无机化合物可根据其组成和性质进行分类:
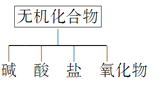
(1)上图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥ 的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ②____ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式:______________________________。