题目内容
4.次磷酸盐可用于化学镀铜,向盛有次磷酸钠和氢氧化钠混合溶液的铁质容器中加入硫酸铜溶液,容器内壁形成牢固的铜镀层,其原理为H2PO2-+Cu2++X-→PO43-+Cu+H2O(未配平),下列有关说法正确的是( )| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 | |
| D. | 该反应每消耗3 mol X-,转移电子的物质的量为2 mol |
分析 由H2PO2-+Cu2++X-→PO43-+Cu+H2O及碱性溶液的信息可知离子反应为H2PO2-+2Cu2++6OH-=PO4-+2Cu+4H2O,P元素的化合价升高,Cu元素的化合价降低,结合化合价的变化计算电子转移;若将硫酸铜溶液换成硝酸银溶液,容器内壁会形成银镀层,以此来解答.
解答 解:A.该反应为H2PO2-+2Cu2++6OH-=PO4-+2Cu+4H2O,次磷酸根离子失电子,作还原剂,表现还原性,故A错误;
B.H2PO2-为还原剂,Cu2+为氧化剂,由方程式可知,氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.若将硫酸铜溶液换成硝酸银溶液,会有银单质生成,则容器内壁会形成银镀层,故C错误;
D.反应中消耗6molOH-,转移4mol电子,则该反应每消耗3 molOH-,转移电子的物质的量为2mol,故D正确;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及转移电子计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列热化学方程式书写正确的( )
| A. | 甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ/mol | |
| B. | 在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)═2SO3(g)△H=-158.4kJ•mol-1 | |
| C. | NaOH(s)+1212H2SO4(浓)═Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ•mol-1 |
15.“含氟牙膏”中的氟应理解为( )
| A. | 单质 | B. | 元素 | C. | 原子 | D. | 分子 |
12.下列苯的同系物中,苯环上的一溴化物只有一种的是( )
| A. | 乙苯 | B. | 邻二甲苯 | C. | 间二甲苯 | D. | 对二甲苯 |
19.相同质量的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,二者比较,相等的是( )
①铜片消耗完所需时间 ②反应中氧化剂得到电子的总数
③反应生成气体的体积(同温、同压) ④反应后溶液中铜离子浓度.
①铜片消耗完所需时间 ②反应中氧化剂得到电子的总数
③反应生成气体的体积(同温、同压) ④反应后溶液中铜离子浓度.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaOH溶液:K+、NH4+、I-、NO3- | |
| B. | 0.1 mol•L-1的CH3COOH溶液:CH3CH2OH、Na+、Al3+、SO42- | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Al3+、NO3-、Cl- | |
| D. | c(H+)c(OH−)=1×1012的溶液:Fe2+、Na+、Cl-、NO3- |
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×105Pa时,32 g O2和O3的混合气体所含原子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,22.4 LCO2含有的原子数约为3NA |
14.不属于人体能够消化吸收的营养物质的是( )
| A. | 糖类、油脂 | B. | 蛋白质、淀粉 | C. | 纤维素 | D. | 水、矿物质 |

 .
.

 与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
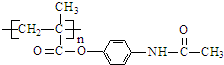
. ;扑热息痛的结构简式为
;扑热息痛的结构简式为 .
. .
.