题目内容
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 25℃,1.01×105Pa时,32 g O2和O3的混合气体所含原子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,22.4 LCO2含有的原子数约为3NA |
分析 A、氧气和臭氧均由氧原子构成;
B、氦气为单原子分子;
C、标况下水为液态;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,个数为2NA个,故A正确;
B、氦气为单原子分子,故含NA个氦原子的氦气分子为NA个,物质的量为1mol,在标况下体积为22.4L,故B错误;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化碳的物质的量小于1mol,则含有的原子个数小于3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.下列有关溶液组成的描述合理的是( )
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| B. | 在氢氧化铁胶体中能大量存在:H+、K+、S2-、Br- | |
| C. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液中一定能大量共存:Na+、[Al(OH)4]-、S2-、CO32- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
4.次磷酸盐可用于化学镀铜,向盛有次磷酸钠和氢氧化钠混合溶液的铁质容器中加入硫酸铜溶液,容器内壁形成牢固的铜镀层,其原理为H2PO2-+Cu2++X-→PO43-+Cu+H2O(未配平),下列有关说法正确的是( )
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 | |
| D. | 该反应每消耗3 mol X-,转移电子的物质的量为2 mol |
1.将铁片和铜片用导线连接置于同一浓硝酸溶液中,下列各叙述正确的是( )
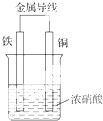

| A. | 铁片上发生氧化反应Fe-3e-═Fe3+ | B. | 铜片上发生还原反应2H++2e-═H2↑ | ||
| C. | 铜片上发生氧化反应Cu-2e-═Cu2+ | D. | 溶液中NO${\;}_{3}^{-}$的浓度基本不变 |
8. 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
(1)①该反应的化学平衡常数表达式是K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$.
②该反应的化学平衡常数K与温度T的关系如下表所示:
其中,K1> K2(填“>”、“=”或“<”).
③理论上,为了增大平衡时H2的转化率,可采取的措施是a、d.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
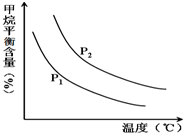
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:16:6:6.
 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.(1)①该反应的化学平衡常数表达式是K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$.
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
③理论上,为了增大平衡时H2的转化率,可采取的措施是a、d.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:16:6:6.
5.下列反应的离子方程式正确的是( )
| A. | 碳酸钙和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁粉和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
3.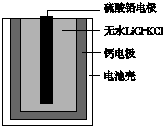 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 常温时,在正负极间接上电流表或检流计,指针不偏转 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 每转移0.2mol电子,理论上生成41.4gPb | |
| D. | 正极反应式:Ca+2Cl--2e-═CaCl2 |
