题目内容
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
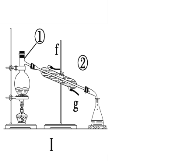
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
【答案】A
【解析】A项,常温下在相同的溶剂中,Na2CO3较NaHCO3易溶,故A正确;B项,NaHCO3受热易分解,要证明热稳定性:Na2CO3>NaHCO3,如图内管中应盛NaHCO3,外管中应盛Na2CO3,故B错误;C项,澄清石灰水与Na2CO3和NaHCO3溶液反应都生成碳酸钙沉淀,现象相同,无法鉴别,故C错误;D项,等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,产生CO2质量相同,Na2CO3和NaHCO3的摩尔质量不同,Na2CO3较大,所以相同质量的Na2CO3和NaHCO3,Na2CO3的物质的量较小,与足量盐酸作用时,Na2CO3放出CO2少,故D错误。

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目