题目内容
【题目】有关物质的转化关系如下图所示。A 是生活中一种常见的调味品,B 是最常见的无色液体,X、Y是两种常见的金属单质。D、E、F为气体,且 E为黄绿色,F能使品红溶液褪色,E 与 F 以等物质的量反应。请回答下列问题:
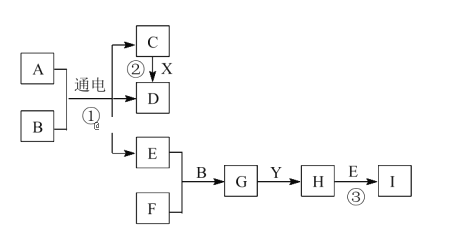
(1)F的化学式是________。溶液 G 中含有的主要离子为_____________(用离子符号表示)。
(2)反应②的化学方程式为___________________。
(3)反应③的离子方程式为________________________________。
(4)请补充完整检验H中阳离子的实验方案:取少量H中的溶液于试管中,_____________
【答案】SO2 H+、Cl-、SO42- 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- 先加KSCN溶液,无现象,再加氯水,溶液变红,H溶液中含Fe2+
【解析】
A 是生活中一种常见的调味品,A是NaCl;B 是最常见的无色液体是H2O;电解饱和食盐水生成NaOH,Cl2和H2,E为黄绿色气体是Cl2,D是H2,C是NaOH,F能使品红溶液褪色,是SO2,X是金属单质能和C反应,故X是Al,、Y是Fe,G是HCl和H2SO4的混合物,H中含Fe2+,I中含中Fe3+。
(1)F的化学式是SO2,SO2、Cl2和水反应生成盐酸和硫酸,溶液 G 中含有的主要离子为:H+、Cl-、SO42-,故答案为:SO2;H+、Cl-、SO42-。
(2)反应②是铝和氢氧化钠的反应,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑, 故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
(3)反应③是Cl2和Fe2+的反应,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl- 。
(4)检验Fe2+的方法是:先加KSCN溶液,无现象,再加氯水,溶液变红,H溶液中含Fe2+,故答案为:先加KSCN溶液,无现象,再加氯水,溶液变红,H溶液中含Fe2+

 阅读快车系列答案
阅读快车系列答案【题目】工业合成氨以及含氮废水的处理一直是工业研究的热点。回答下列问题:
(1)已知:氢气的燃烧热为-285.8kJ/mol,17g氨气在纯氧中燃烧生成氮气和液态水的过程中放热382.6kJ,则工业合成氨的热化学方程式为_________________。
(2)500℃时,在容积固定的密闭容器中模拟工业合成氢N2+3H2![]() 2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
时间/min | c(N2)/mol/L | c(H2)/mol/L | c(NH3)/mol/L |
0 | 0.18 | 2.3 | 0 |
5 | 0.08 | ||
6 | 0.08 | ||
10 | 0.06 | 1.94 | 0.24 |
500℃时,该反应的化学平衡常数K=_______L2·mol-2;5min内,反应的平均速率v(H2)_____ mol·L-1·min-1;6min时,某一条件发生了改变,可能是_____(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.分离出NH3
(3)无机含氮废水主要含有铵氮(NH4+)和硝氮(NO3-)。可使用电化学氧化法处理铵氮废水,原理是溶液中的NH4+直接在电极上放电生成无毒物质,该过程阳极上的电极反应式为_______________。为研究电化学氧化法去除铵氮的影响因素,在实验室中以石墨作电极模拟对高浓度铵氮废水进行电化学氧化处理,得到如下3组图像:



通过分析上述图像可知,最适宜选用的条件是___________、以及初始pH为11的碱性溶液。实验中,铵氮去除率总是高于总氮去除率的原因是__________________。
【题目】下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3+ + 3OH- =Fe(OH)3↓ |
B | K+、ClO-、SO42- | 盐酸 | H++ClO- =HClO |
C | K+、OH-、Cl- | 过量SO2 | SO2+ OH-=HSO3- |
D | H+、Fe2+、 SO42- | Ba(NO3)2溶液 | SO42-+ Ba2+ =BaSO4↓ |
A. A B. B C. C D. D