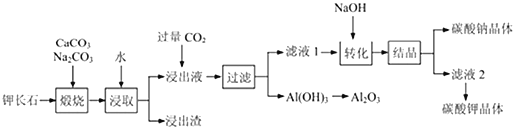
题目内容
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是

A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) < c(CH3COOH)
C. c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-)
D. d点水的电离程度大于c点
【答案】A
【解析】a点是浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液,c(H+)≈0.01 mol·L-1,c(CH3COO-)=![]() ,故A正确;b点溶质为等浓度的氯化铵和醋酸,Ka(CH3COOH)=1.7×10-5,Kh(NH4+)=
,故A正确;b点溶质为等浓度的氯化铵和醋酸,Ka(CH3COOH)=1.7×10-5,Kh(NH4+)=![]() ,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,所以c(NH4+)>c(CH3COOH),故B错误;c点溶液呈酸性c(H+) > c(OH-),根据电荷守恒,c(NH4+)+ c(H+) > c(Cl-)+c(CH3COO-)+ c(OH-),所以c(NH4+)< c(Cl-)+c(CH3COO-),故C错误;c点氯化铵、醋酸铵均促进水的电离,d点还存在抑制水的电离的一水合氨,所以c点水的电离程度大于d点,故D错误。
,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,所以c(NH4+)>c(CH3COOH),故B错误;c点溶液呈酸性c(H+) > c(OH-),根据电荷守恒,c(NH4+)+ c(H+) > c(Cl-)+c(CH3COO-)+ c(OH-),所以c(NH4+)< c(Cl-)+c(CH3COO-),故C错误;c点氯化铵、醋酸铵均促进水的电离,d点还存在抑制水的电离的一水合氨,所以c点水的电离程度大于d点,故D错误。

练习册系列答案
相关题目