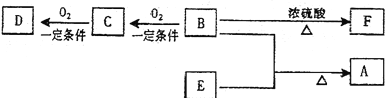
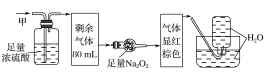
题目内容
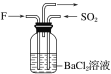
【题目】某兴趣小组探究Ba(OH)2溶液和 H2SO4溶液发生的是离子反应,设计的实验装置和实验测定的导电性曲线分别如图所示。下列有关说法错误的是
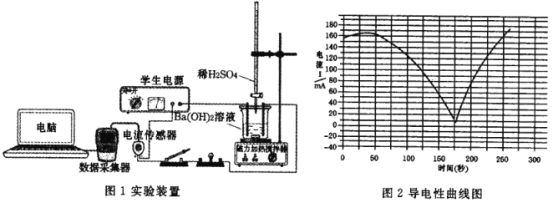
A.该反应的离子方程式是 Ba2+ +2OH- +SO42-+2H+=BaSO4↓+ 2H2O
B.实验过程中灯泡的亮度发生变化可以说明该反应为离子反应
C.导电能力最低点表示 Ba(OH)2 溶液和 H2SO4溶液恰好完全反应
D.用盐酸代替H2SO4溶液,测得的导电性曲线和上述曲线相同
【答案】D
【解析】
A. Ba(OH)2溶液和H2SO4溶液发生生成硫酸钡和水,离子方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,A项正确;
B. 导电能力约为0时,Ba(OH)2与硫酸反应恰好完全反应,溶液中几乎没有自由移动的离子,可以说明该反应为离子反应,B项正确;
C. 导电能力最低点,此时Ba(OH)2与硫酸反应恰好完全反应,溶液中几乎没有自由移动的离子,C项正确;
D. 用盐酸代替H2SO4溶液,发生的反应为:Ba(OH)2+2HCl= BaCl2+2H2O,其实质是OH-+H+= H2O,其导电能力不会降为0,可知测得的导电性曲线和上述曲线不相同,D项错误;
答案选D。

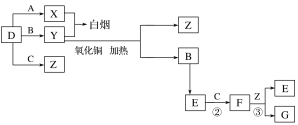
【题目】Na2S2O3可用于照相业作定影剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制备,装置如图。

(1)仪器a的名称为____。
(2)A装置中,NaOH溶液的作用是___。
(3)D中生成Na2S2O3的化学方程式为___。
(4)装置C的作用有___、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是___。
(5)本实验所需的Na2S可由硫化钠碱坯(主要含Na2S,还含少量Na2SO4、炭粉等杂质)制备。
已知Na2S的溶解度、固相成分与温度的关系如表:
温度/℃ | 溶解度/g | 固相 |
-10 | 10.3 | Na2S·9H2O+冰 |
10 | 13.6 | Na2S·9H2O |
20 | 18.7 | Na2S·9H2O |
40 | 28.5 | Na2S·9H2O |
48 | 35.7 | Na2S·9H2O+Na2S·6H2O |
60 | 39.1 | Na2S·6H2O |
80 | 49.1 | Na2S·6H2O |
91.5 | 61.3 | Na2S·6H2O+Na2S·5.5H2O |
请补充完整由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,__,得到Na2S·9H2O晶体(须用的试剂:BaS、无水乙醇)。