题目内容
.(12分)由等物质的量的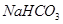 和
和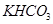 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中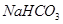 与
与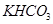 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为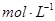 。
。
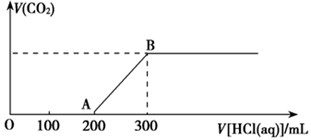
(3)如果盐酸过量,生成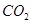 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成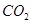 的体积,还需要知道 。
的体积,还需要知道 。
(5)若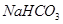 和
和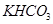 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
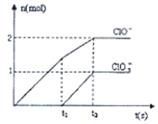
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成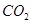 的物质的量(用n表示)的范围是 。
的物质的量(用n表示)的范围是 。
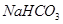 和
和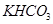 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。) (1)该混合物中
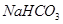 与
与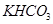 的质量分别为 和 。
的质量分别为 和 。(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为
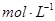 。
。(3)如果盐酸过量,生成
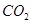 的体积为 L。
的体积为 L。(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成
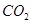 的体积,还需要知道 。
的体积,还需要知道 。(5)若
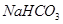 和
和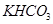 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成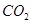 的物质的量(用n表示)的范围是 。
的物质的量(用n表示)的范围是 。(12分,每空2分)(1)8.4 g 10 g (2)2 (3)4.48
(4)盐酸的物质的量浓度(或其他合理答案) (5)0.184<n<0.219
(4)盐酸的物质的量浓度(或其他合理答案) (5)0.184<n<0.219
(1)设二者的物质的量都是x,则84x+100x=18.400,解得x=0.1mol,所以混合物中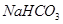 与
与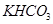 的质量分别为8.4g和10.0g。
的质量分别为8.4g和10.0g。
(2)碳酸氢盐与盐酸的方程式为H++HCO3-=H2O+CO2↑,所以消耗的盐酸是0.2mol,浓度是2.0mol/L。
(3)根据碳原子守恒可知,生成的CO2是0.2mol,标准状况下的体积是4.48L。
(4)如果盐酸不足,则要计算生成的CO2体积,还需要知道盐酸的浓度。
(5)可以采用极值法。如果全部是碳酸氢钠,则生成CO2是 ;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
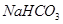 与
与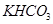 的质量分别为8.4g和10.0g。
的质量分别为8.4g和10.0g。(2)碳酸氢盐与盐酸的方程式为H++HCO3-=H2O+CO2↑,所以消耗的盐酸是0.2mol,浓度是2.0mol/L。
(3)根据碳原子守恒可知,生成的CO2是0.2mol,标准状况下的体积是4.48L。
(4)如果盐酸不足,则要计算生成的CO2体积,还需要知道盐酸的浓度。
(5)可以采用极值法。如果全部是碳酸氢钠,则生成CO2是
 ;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
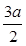 mol
mol  mol
mol mol
mol mol
mol