题目内容
某硫酸铝溶液中含 Al3+ ag ,则溶液中 SO42-的物质的量为 ( )
A.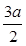 mol mol | B. mol mol | C. mol mol | D. mol mol |
D
铝离子的物质的量是 ,根据化学式Al2(SO4)3可知, SO42-的物质的量为
,根据化学式Al2(SO4)3可知, SO42-的物质的量为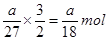 ,答案选D。
,答案选D。
 ,根据化学式Al2(SO4)3可知, SO42-的物质的量为
,根据化学式Al2(SO4)3可知, SO42-的物质的量为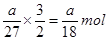 ,答案选D。
,答案选D。
练习册系列答案
相关题目
题目内容
A.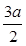 mol mol | B. mol mol | C. mol mol | D. mol mol |
 ,根据化学式Al2(SO4)3可知, SO42-的物质的量为
,根据化学式Al2(SO4)3可知, SO42-的物质的量为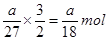 ,答案选D。
,答案选D。