��Ŀ����
����Ŀ����ͳ�Ķ�����ѧʵ���ܵ������ֶε���Լ���о���Χ��խ����ȷ�Ȳ��ߡ�DIS���ֻ���Ϣϵͳ���ɴ����������ݲɼ����ͼ������ɣ���Ϊ����ȷ������Һ��pH�ȶ����к͵ζ����о���Ӧ��Խ��Խ�㷺���롣

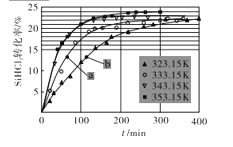
��1��ijѧϰС������DISϵͳ̽��ǿ��Ͳ�ͬ����кͷ�Ӧ��ʵ��������£�
�ٷֱ�����0.1000mol/L��NaOH��HCl��CH3COOH��Һ���á�
����0.1000mol/L��NaOH��Һ�ֱ�ζ�10.00mL0.1000mol/L��HCl��CH3COOH��Һ���������ݲɼ�����pH��������
���ɼ�������Ƶĵζ�������ͼһ��
������ͼ��㲻ͬ��ԭ����_____��������ͼ��V1_____V2 �����������������������
��2����һ��ѧϰС������DISϵͳ�ⶨij������Һ�����ʵ���Ũ�ȣ��Բ�����Һ�����������жϵζ��յ㣬ʵ�鲽�����£�
����_____�����������ƣ���ȡ20.00mL������Һ��Ʒ������ྻ������ƿ�У����Ӻ�DISϵͳ�������ƿ�к���������ˮ���Ƿ��Ӱ��������_____����ǡ�������������ȷ������������ƿ�еμ�0.1000mol/L��NaOH��Һ���������Ļ����ʾ����Һ�������������NaOH��Һ�����ϵ������ͼ����ͼ������
�ڴ�����NaOH��Һ��Ӧ�����ӷ���ʽΪ___________________________��
��ͼ��b��ʱ����Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��_____________________��
����ͼ��ijһ��pH����8����c(Na+)��c(CH3COO��)�ľ�ȷֵΪ_____mol/L��
���𰸡�CH3COOH����ȫ���룬HCl��ȫ���룬��0.1mol/L��CH3COOH��Һ��c(H+����ͬŨ�ȵ�HCl��Һ��c(H+)С��pH�ϴ� �� ��ʽ�ζ��� �� CH3COOH+OH����CH3COO��+H2O c(Na+)��c(CH3COO��)��c(OH��)��c(H+) 9.9��10��7
��������
��������к͵ζ���ԭ�����з�������������ˮ��Ĺ��ɷ�����Һ������Ũ�ȵĴ�С��ϵ��������Һ�еĵ���غ�ȷ�����Һ�еĵ�����ϵ��
��1�����������ᣬ��������ǿ�ᣬ��ˣ�������ͼ��㲻ͬ��ԭ���ǣ�CH3COOH����ȫ���룬HCl��ȫ���룬�� 0.1mol/L��CH3COOH��Һ��c(H+)��ͬŨ�ȵ�HCl��Һ��c(H+)С��pH�ϴ���������ǡ�������кͷ�Ӧ�����ĵı�Һ�����Ӧ��ȣ��������߽Է�Ӧ��pH=7ʱ�����ڴ�����ˮ���ʹ��Һ�ʼ��ԣ�����������Ƚϣ���Ҫ�ټ�һЩ����Һ����ʹpH=7����ˣ�������ͼ��V1��V2 ��
��2��������ʽ�ζ�����ȡ20.00mL������Һ��Ʒ������ྻ������ƿ�У����Ӻ�DISϵͳ�������ƿ�к���������ˮ������Ӱ�쵽��������ʵ������ʲ���Ӱ���������������
�ڴ�����NaOH��Һ��Ӧ�����ӷ���ʽΪCH3COOH+OH����CH3COO��+H2O��
��ͼ��b��ʱ�����������Һǡ����ȫ��Ӧ��������ҺΪ��������Һ�����ڴ��������ֻ�к��ٵ�һ���ַ���ˮ�⣬������Һ�������ԣ�ˮ�ĵ���̶Ⱥ�С������Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��c(Na+)��c(CH3COO��)��c(OH��)��c(H+)��
����ͼ��ijһ��pH����8��c(H+)=110-8mol/L��c(OH��)=110-6mol/L�����ݵ���غ��֪��c(CH3COO��)+ c(OH��)= c(Na+)+c(H+)����c(Na+)��c(CH3COO��)= c(OH��)- c(H+)=110-6mol/L-110-8mol/L=9.9��10��7 mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������ͼװ�ÿ��Խ���ʵ�鲢�ܴﵽʵ��Ŀ�ĵ���
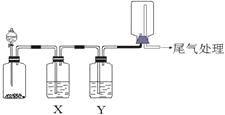
ѡ�� | ʵ��Ŀ�� | X���Լ� | Y���Լ� |
A[] | ��MnO2��Ũ������ȡ���ռ����������Cl2 | ����ʳ��ˮ | Ũ���� |
B | ��Cu��ϡ������ȡ���ռ����������NO | ˮ | Ũ���� |
C | ��֤��ʯ�뱥��ʳ��ˮ��Ӧ���ɵ���������ʲ��ռ� | CuSO4��Һ | KMnO4 |
D | CaCO3��ϡ������ȡ���ռ����������CO2 | ����NaHCO3��Һ | Ũ���� |
A. A B. B C. C D. D
����Ŀ�����������벻����ѧ�������Dz�������θҩ�����ű�ǩ�IJ�����Ϣ��
��������Ƭ Ӣ������Ferrous Sulfate Tablets ��Ʒ������������FeSO4��7H2O��ӦΪ��ʾ����95��0%~110��0% | ��������Ƭ Ӣ������Aluminium Hydroxide Tablets |
����Ҫ�ɷ֣����¡�̼��þ���������������� | |
����״����ƷΪ���£���ȥ���º��Ե���ɫ | ����Ӧ֢���ܻ���θ����� |
������ȡ��Ʒ����ȥ���£���ȡ������Լ�൱����������Ƭ0��2g������ϡ����1����ˮ20mL����ҡʹ���������ܽ⣬���ˣ���Һ�����������������εļ���Ӧ | ���÷����������ˣ��ڷ���һ��0��6~0��9g��һ��2~3Ƭ����һ��3�Σ���ǰ1Сʱ���� |
����ϸ�÷������˵���� |
I����������������Ƭ����ǩ�ش����⣺
��1����������Ƭ����ˮ����Һ����ɫ��_______________��
��2���������м���![]() �����ӷ�Ӧ����ʽ��______________________________________��
�����ӷ�Ӧ����ʽ��______________________________________��
��3�������У�����ϡ����1������������__________________________________________��
��4��������������Ƭ�Ƿ������ķ�����________________________________________��
II����������������Ƭ����ǩ�ش����⣺
��1���ܻ���θ�����ijɷ���__________________________________________��
��2��������������Ϊ����θ�������ڷ�ҩ����������������������______________��
A�� ���� B�� ���� C�� ���� D�� ������
��3��д�����������ĵ��뷽��ʽ��_____________________________________________��