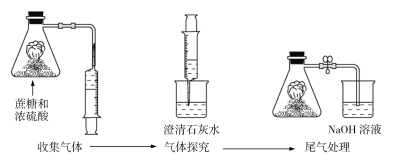
��Ŀ����
����Ŀ��
��ԭ�ӿ����γ� �� ������ ������ �� ������λ�����ɼ��Ķ�����ʹ���γ��˶��־��ж�����ɵ����ʡ��ش��� �����⣺
(1)��һ�����ܣ���______��(��������������С����)����̬��ԭ�Ӽ۵����Ų�ͼ����![]() ������ Ϊ���Ų���ʽΥ����__________��
������ Ϊ���Ų���ʽΥ����__________��
(2)��(H2NNH2)�����йµ��Ӷ��� �� ������Ŀ֮��Ϊ______���µ���Է�����������ϩ�ӽ������е�Զ������ϩ��ԭ����______��
( 3)����Ľṹ�ɱ� ʾ Ϊ ![]() ��������ˮ���ӿ� �� ��һˮ�϶�����ᾧ ˮ ���� (2HNO3 H2O) �� ˮ�������������������������ӽ�ϣ���д��һˮ�϶�����Ľṹʽ______(��������������ʾ)��
��������ˮ���ӿ� �� ��һˮ�϶�����ᾧ ˮ ���� (2HNO3 H2O) �� ˮ�������������������������ӽ�ϣ���д��һˮ�϶�����Ľṹʽ______(��������������ʾ)��
(4)��������(Na3NO4)Ϊ��ɫ���壬��һ����Ҫ�Ļ���ԭ�ϡ�
��Na3NO4 �����ӵĿռ乹��Ϊ______��������ԭ���ӻ���ʽΪ______��
�ڷֱ�д��һ���� Na3NO4 �������ӻ�Ϊ�ȵ�����������Ӻͷ���______(�ѧʽ)��
���� 573 K �����£�ʵ�������� NaNO3 �� Na2O �������з�Ӧ�Ƶ� Na3NO4��Na2O ������������ͼ�� ʾ��

ͼ��������ʾ______(����Na+������O2��)��������������ҵȾ����������______����Na2O �����IJ���Ϊ a pm�����ܶ�Ϊ_____gcm3��(�г�����ʽ���ɣ�NA Ϊ�����ӵ�������ֵ)
���𰸡����� ���ع��� 2:5 �·��Ӽ�����������ϩ���Ӽ������ ![]() �������� sp3 SO42-��CCl4 O2- 8
�������� sp3 SO42-��CCl4 O2- 8 
��������
��1����̬��ԭ�ӵ�2p���Ϊ�ȶ��İ����״̬��������Ԫ��ԭ����ʧȥ���ӣ����ݺ��ع����ӷֲ���������ͬ�Ĺ��ʱ��������������ͬ�ķ�ʽռ�ݲ�ͬ�����
��2���µĽṹʽΪ![]() ��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��
��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��![]() �������к��������
��������������
��3��ˮ�������������������������ӽ��������γ�λ��д���ṹʽ��
��4����![]() �����ӵ�����ԭ��Ϊ
�����ӵ�����ԭ��Ϊ![]() ���۲���Ӷ���Ϊ
���۲���Ӷ���Ϊ![]() ��
��
����![]() �������ӻ�Ϊ�ȵ�����������Ӻͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�
�������ӻ�Ϊ�ȵ�����������Ӻͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�
��Na2O ������������ԭ�Ӹ�������ϻ�ѧʽ�ж��������࣬���ù�ʽ![]() �����㾧���ܶȡ�
�����㾧���ܶȡ�
��1����̬��ԭ�ӵ�2p���Ϊ�ȶ��İ����״̬��������Ԫ��ԭ����ʧȥ���ӣ���˵�һ�����ܣ������������ݺ��ع����ӷֲ���������ͬ�Ĺ��ʱ��������������ͬ�ķ�ʽռ�ݲ�ͬ���������еĵ����Ų�ͼ�У�������2p��ͬһ��������Ų������������෴�ĵ��ӣ�Υ���˺��ع���
�ʴ�Ϊ�����ڣ����ع���
��2���µĽṹʽΪ![]() ��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��
��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��![]() ������˹µ��Ӷ���
������˹µ��Ӷ���![]() ������Ŀ֮��Ϊ2:5��Hԭ����N��O��F��ԭ���γɹ��ۼ�ʱ�����Ӽ�ͨ���ܹ��γ����������۷е����ߣ������µķе�Զ������ϩ��
������Ŀ֮��Ϊ2:5��Hԭ����N��O��F��ԭ���γɹ��ۼ�ʱ�����Ӽ�ͨ���ܹ��γ����������۷е����ߣ������µķе�Զ������ϩ��
�ʴ�Ϊ��2:5���·��Ӽ�����������ϩ���Ӽ������
��3��ˮ�������������������������ӣ������ΪH��N��O��F֮����ڵļ�����һˮ�϶�����ĽṹʽΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��4����![]() �����ӵ�����ԭ��Ϊ
�����ӵ�����ԭ��Ϊ![]() ���۲���Ӷ���Ϊ
���۲���Ӷ���Ϊ![]() ���ӻ���ʽΪ
���ӻ���ʽΪ![]() ���ռ乹��Ϊ�������壻
���ռ乹��Ϊ�������壻
�ʴ�Ϊ���������壻![]() ��
��
����![]() �������ӻ�Ϊ�ȵ����������ͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�����Ҫ�����������
�������ӻ�Ϊ�ȵ����������ͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�����Ҫ�����������![]() �ȣ�����Ҫ��ķ�����
�ȣ�����Ҫ��ķ�����![]() �ȣ�
�ȣ�
�ʴ�Ϊ��SO42-��CCl4�ȣ�
���ɾ���ʾ��ͼ��֪��������![]() ����������Ϊ8����ѧʽΪNa2O��������ʾO2-��������ʾNa+���ɾ���ʾ��ͼ��֪������������ҵȾ����������8���������ܶ�
����������Ϊ8����ѧʽΪNa2O��������ʾO2-��������ʾNa+���ɾ���ʾ��ͼ��֪������������ҵȾ����������8���������ܶ�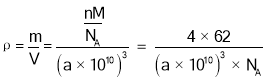 ��
��
�ʴ�Ϊ��O2-��8�� ��
��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�