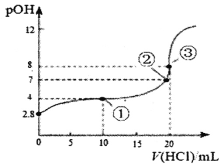
题目内容
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
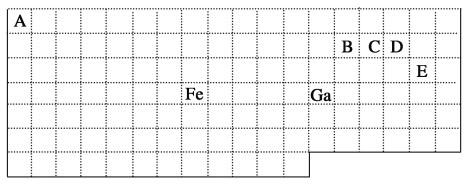
根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为___________。
(2)Fe元素位于周期表的________分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为_______。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________。
(4)根据VSEPR理论预测ED4-的空间构型为________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的分子式为_________(写2种)。
【答案】4s24p1 d 0 CH4、CH3OH 正四面体形 CO2、NCl3、CCl4、CO中任意两种
【解析】
根据元素在周期表的相对位置,可知A是H元素,B是C元素,C是N元素,D是O元素,E是Cl元素,然后根据元素周期表与元素原子结构、物质性质分析解答。
(1)31号Ga元素在元素周期表中位于第四周期第IIIA族,其核外最外层电子排布式是4s24p1;
(2)Fe是26号元素,原子核外电子排布式是1s22s22p63s23p63d64s2,Fe元素位于周期表第四周期第VIII族,属于d区元素;Fe与CO易形成配合物Fe(CO)5,由于配位体CO是中性分子,因此根据化合物中元素化合价代数和等于0可知:在配位化合物Fe(CO)5中铁的化合价为0价;
(3)在CH4、CO、CH3OH中,CH4、CH3OH中的碳原子都形成4个共价键,C采取sp3杂化;而CO中C原子与O原子形成共价三键,结构式是C≡O,因此C原子采用sp杂化;
(4)E为Cl,D为O,则ED4-离子为ClO4-,根据VSEPR理论,中心Cl原子的配位原子数BP=4,孤电子对数为LP=![]() =0,则价电子对数为VP=BP+LP=4+0=4,因此其空间构型为正四面体;
=0,则价电子对数为VP=BP+LP=4+0=4,因此其空间构型为正四面体;
B为C,C为N,则B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为CO2、NCl3、CCl4、CO。

【题目】与化学平衡类似,电离平衡的平衡常数叫作电离平衡常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数 |
CH3COOH | CH3COOH | K=1.96×10-5 |
HClO | HClO | K=3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是___(填化学式,下同),最弱的是___。
(2)向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为___。
(3)求出该温度下,0.10mol·L-1的CH3COOH溶液中的c(H+)=____mol·L-1。
【题目】下表为某机物与对应试剂的反应现象或是否反应,则这种有机物可能是( )
试剂 | 钠 | 溴水 | NaHCO3溶液 |
现象 | 放出气体 | 褪色 | 放出气体 |
A.CH2=CH-CH2-OH
B.![]()
C.CH2=CH-COOH
D.CH3COOH