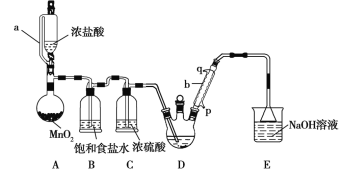
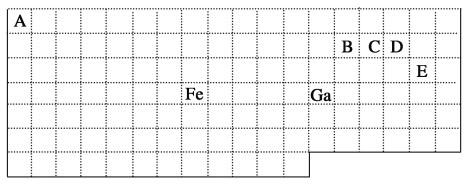
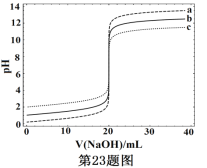
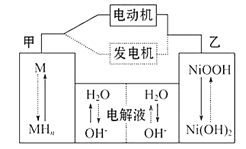
题目内容
【题目】硫代硫酸钠(Na2S2O3)是常用的还原剂。在一定体积的某维生素C(化学式C6H8O6)溶液中加入a mol·L-1I2溶液V1 mL,使维生素C完全氧化,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。
已知发生的反应为:C6H8O6+I2=C6H6O6+2H++2I- , 2S2O32-+I2=S4O62-+2I-
该溶液中维生素C的物质的量是多少mol?(写出简要的计算过程)。
【答案】(aV1- 0.5bV2) ×10-3
【解析】
根据2S2O32-+I2=S4O62-+2I-,剩余碘的物质的量=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×V2×10-3L×bmol·L-1=0.5bV2×10-3mol,则氧化维生素C消耗的碘的物质的量为V1×10-3L×amol·L-1- 0.5bV2×10-3mol =(aV1- 0.5bV2) ×10-3mol,再根据C6H8O6+I2=C6H6O6+2H++2I-,碘单质氧化维生素C按1:1反应,则维生素C的物质的量=氧化维生素C消耗的碘的物质的量=(aV1- 0.5bV2) ×10-3mol。
×V2×10-3L×bmol·L-1=0.5bV2×10-3mol,则氧化维生素C消耗的碘的物质的量为V1×10-3L×amol·L-1- 0.5bV2×10-3mol =(aV1- 0.5bV2) ×10-3mol,再根据C6H8O6+I2=C6H6O6+2H++2I-,碘单质氧化维生素C按1:1反应,则维生素C的物质的量=氧化维生素C消耗的碘的物质的量=(aV1- 0.5bV2) ×10-3mol。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目