题目内容
【题目】在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是

A. 图中②点所示溶液的导电能力弱于①点
B. ③点处水电离出的c(H+)=1×10-8mol·L-1
C. 图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25℃时氨水的Kb约为5×10-5.6mo1·L-1
【答案】D
【解析】
A.向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1,盐酸和氨水恰好完全反应生成氯化铵和水,氯化铵中铵根水解显酸性,因而②(pH=7)时,氨水稍过量,即反应未完全进行,从①到②,氨水的量减少,氯化铵的量变多,又溶液导电能力与溶液中离子浓度呈正比,氯化铵为强电解质,完全电离,得到的离子(铵根的水解不影响)多于氨水电离出的离子(氨水为弱碱,少部分NH3·H2O发生电离),因而图中②点所示溶液的导电能力强于①点,A错误;
B.观察图像曲线变化趋势,可推知③为盐酸和氨水恰好完全反应的点,得到氯化铵溶液,盐类的水解促进水的电离,因而溶液pOH=8,则c溶液(OH-)=10-8mol/L,c水(OH-)= c水(H+)=Kw/ c溶液(OH-)=10-6mol/L,B错误;
C.①点盐酸的量是③点的一半,③为恰好完全反应的点,因而易算出①点溶液溶质为等量的NH3·H2O和NH4Cl,可知电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-),又①pOH=4,说明溶液显碱性,则c(OH-)> c(H+),那么c(NH4+)> c(Cl-),C错误;
D.V(HCl)=0时,可知氨水的pOH=2.8,则c(OH-)=10-2.8mol/L,又NH3·H2ONH4++OH-,可知c(NH4+)= c(OH-)=10-2.8mol/L,③点盐酸和氨水恰好反应,因而c(NH3·H2O)=![]() mol/L=0.2mol/L,因而Kb=
mol/L=0.2mol/L,因而Kb=![]() =
=![]() =5×10-5.6mo1·L-1,D正确。
=5×10-5.6mo1·L-1,D正确。
故答案选D。

【题目】KMnO4是实验室中常用的一种试剂。回答下列问题:
(1)K+的结构示意图为___。
(2)在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4,弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,若将该反应设计成原电池,则负极反应式为___。
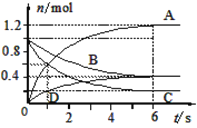
(3)在10mL0.1mol·L-1KMnO4溶液(含稀硫酸)中加入15mL0.5mol.L-1草酸溶液,收集到的CO2的量与时间的关系如图所示。
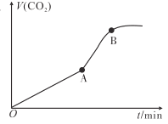
AB段反应速率增大的原因可能是___(填字母)。
a.该反应是放热反应
b.反应物浓度增大
c.K2SO4起催化作用
d.MnSO4起催化作用
(4)为了探究外界条件对化学反应速率的影响,设计如下方案:
实验 | 0.1mol·L-1KMnO4/mL | 0.5mol·L-1H2C2O4/mL | 0.1mol·L-1H2SO4/mL | 水浴 温度/℃ | 蒸馏水 /mL | 褪色时间 /min |
I | 5.0 | 15.0 | 5.0 | 35 | 0 | t1 |
II | 5.0 | 10.0 | 5.0 | 35 | V | t2 |
III | 5.0 | 15.0 | 3.0 | 35 | 2.0 | t3 |
IV | 5.0 | 15.0 | 5.0 | 45 | 0 | t4 |
①V=___。
②该实验方案不能探究对反应速率有影响的因素是___。
A.浓度 B.酸度 C.温度 D.催化剂
③若测得结果:t4<t1,则实验结论是___。