题目内容
(2011?南京三模)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度. 目前,消除氮氧化物污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式
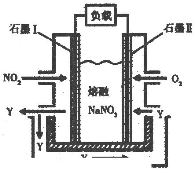
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应
可表示为
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1 / 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
0.56
0.56
(保留两位小数).②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
减小CO2的浓度
减小CO2的浓度
.③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H
<
<
0(填“>”、“=”或“<”).(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应
可表示为
NO2+NO3--e-=N2O5
NO2+NO3--e-=N2O5
.
分析:(1)①依据图表数据结合化学平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积计算得到;
②依据图表数据计算分析判断;
③依据平衡浓度之比和30min前达到的平衡浓度比较分析平衡移动方向,结合平衡移动原理判断反应热量变化;
(2)依据热化学方程式和盖斯定律计算得到;
(3)燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成氧化物N2O5的电极,再根据离子的放电顺序写出电极反应式;
②依据图表数据计算分析判断;
③依据平衡浓度之比和30min前达到的平衡浓度比较分析平衡移动方向,结合平衡移动原理判断反应热量变化;
(2)依据热化学方程式和盖斯定律计算得到;
(3)燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成氧化物N2O5的电极,再根据离子的放电顺序写出电极反应式;
解答:解:(1)①平衡状态物质的平衡浓度为,c(NO)=0.04mol/L;c(N2)=0.03mol/L;c(CO2)=0.03mol/L;K=
=
=0.56;
故答案为:0.56;
②30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.034mol/L;c(CO2)=0.017mol/L;c(NO)=0.032mol/L;K=
=
=0.56,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以可能是减小二氧化碳浓度;故答案为:减小CO2的浓度;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,和图表数据分析判断,平衡逆向进行,由平衡移动原理可知,升温平衡向吸热反应方向进行,所以正反应为放热反应;反应的△H<0;
故答案:<;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
依据盖斯定律(①+②+③×4)÷2得到:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1;
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,二氧化氮在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,反应的电极反应为:NO2+NO3--e-=N2O5;
故答案为:NO2+NO3--e-=N2O5;
| c(N2)c(CO2) |
| c2(NO) |
| 0.03×0.03 |
| 0.04 |
故答案为:0.56;
②30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.034mol/L;c(CO2)=0.017mol/L;c(NO)=0.032mol/L;K=
| c(N2)c(CO2) |
| c2(NO) |
| 0.034×0.017 |
| 0.0322 |
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,和图表数据分析判断,平衡逆向进行,由平衡移动原理可知,升温平衡向吸热反应方向进行,所以正反应为放热反应;反应的△H<0;
故答案:<;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
依据盖斯定律(①+②+③×4)÷2得到:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1;
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,二氧化氮在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,反应的电极反应为:NO2+NO3--e-=N2O5;
故答案为:NO2+NO3--e-=N2O5;
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡的影响因素分析化学平衡移动原理的应用,平衡常数计算判断,原电池原理的应用和电极反应书写,题目难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
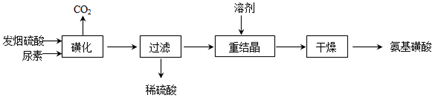
 (2011?南京三模)核能源已日益成为当今世界的主要能源.
(2011?南京三模)核能源已日益成为当今世界的主要能源.