题目内容
(2011?南京三模)常温下,下列各组离子在指定溶液中能大量共存的是( )
分析:A.pH=l的溶液有大量的H+,利用复分解反应来分析;
B.该组离子之间不反应;
C.c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,利用复分解反应来分析;
D.利用氧化还原反应来分析.
B.该组离子之间不反应;
C.c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,利用复分解反应来分析;
D.利用氧化还原反应来分析.
解答:解:A.pH=l的溶液有大量的H+,与AlO2-结合生成沉淀,继续反应生成铝离子,则不能共存,故A不选;
B.因该组离子之间不反应,能共存,故B选;
C.c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,NH4+、OH-结合生成弱电解质,则不能共存,故C不选;
D.因MnO4-、I-能发生氧化还原反应,则不能共存,故D不选;
故选B.
B.因该组离子之间不反应,能共存,故B选;
C.c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,NH4+、OH-结合生成弱电解质,则不能共存,故C不选;
D.因MnO4-、I-能发生氧化还原反应,则不能共存,故D不选;
故选B.
点评:本题考查离子的共存问题,明确信息及信息的应用是解答本题的关键,熟悉复分解反应发生的条件及离子之间的反应即可解答,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目

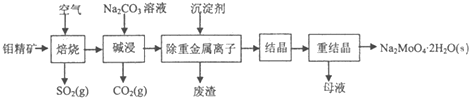
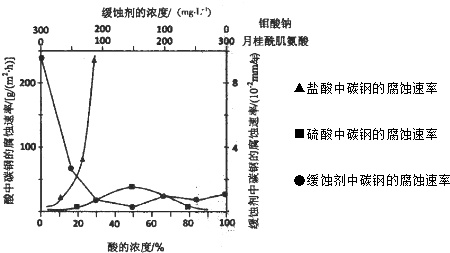
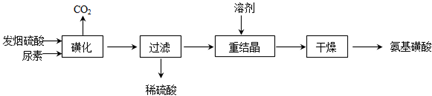
 (2011?南京三模)核能源已日益成为当今世界的主要能源.
(2011?南京三模)核能源已日益成为当今世界的主要能源.