题目内容
(2011?南京三模)氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇.在工业上用作酸性清洗剂、阻燃剂、磺化剂.用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的稀的路线如下:
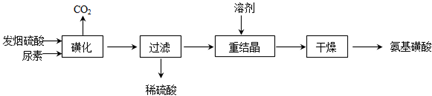
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s)+SO3(g)?H2NCONHSO3H(s)△H<0
②H2NCONHSO3H+H2SO4?2H2NSO3H+CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol?L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol?L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2.试求产品中氨基磺酸的质量分数.(请写出计算过程)
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有

(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是
氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小
氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s)+SO3(g)?H2NCONHSO3H(s)△H<0
②H2NCONHSO3H+H2SO4?2H2NSO3H+CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是
温度高,SO3气体逸出加快,使反应①转化率降低.温度高,反应①平衡向逆反应方向移动
温度高,SO3气体逸出加快,使反应①转化率降低.温度高,反应①平衡向逆反应方向移动
.(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol?L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol?L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2.试求产品中氨基磺酸的质量分数.(请写出计算过程)
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有
硫酸
硫酸
杂质.分析:(1)根据溶质在不同溶剂中的溶解度大小分析;
(2)温度越高,三氧化硫的逸出速率越大,升高温度,平衡向吸热反应方向移动;
(3)当溶液变蓝色时,说明H2NSO3H恰好完全反应,根据H2NSO3H和NaNO2之间的关系式计算H2NSO3H的物质的量,再根据质量分数公式进行计算;
(4)用氢氧化钠测定氨基磺酸的纯度,测定结果通常比NaNO2法偏高,说明还有其它物质和氢氧化钠反应.
(2)温度越高,三氧化硫的逸出速率越大,升高温度,平衡向吸热反应方向移动;
(3)当溶液变蓝色时,说明H2NSO3H恰好完全反应,根据H2NSO3H和NaNO2之间的关系式计算H2NSO3H的物质的量,再根据质量分数公式进行计算;
(4)用氢氧化钠测定氨基磺酸的纯度,测定结果通常比NaNO2法偏高,说明还有其它物质和氢氧化钠反应.
解答:解:(1)反应H2NCONHSO3H+H2SO4?2H2NSO3H+CO2↑是可逆反应,硫酸浓度增大,平衡向正反应方向移动,所以能抑制氨基磺酸的溶解,故答案为:氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小;
(2)温度越高,三氧化硫气体逸出速率加快,且CO(NH2)2(s)+SO3(g)?H2NCONHSO3H(s)是放热反应,升高温度,平衡向逆反应方向移动,从而抑制氨基磺酸的产率,故答案为:温度高,SO3气体逸出加快,使反应①转化率降低.温度高,反应①平衡向逆反应方向移动;
(3)当溶液变蓝色时,说明H2NSO3H恰好完全反应,氨基磺酸和亚硝酸钠的反应方程式为:H2NSO3H+NaNO2=NaHSO4+N2↑+H2O,根据方程式知,n (H2NSO3H)=n(NaNO2)=25.00×l0-3×0.08000 mol?L-1=2.000×l0-3 mol;
ω(H2NSO3H)=
×100%=98.0%,故答案为:98.0%;
(4)用氢氧化钠测定氨基磺酸的纯度,测定结果通常比NaNO2法偏高,说明还有其它物质和氢氧化钠反应,能和氢氧化钠反应的物质是硫酸,故答案为:硫酸.
(2)温度越高,三氧化硫气体逸出速率加快,且CO(NH2)2(s)+SO3(g)?H2NCONHSO3H(s)是放热反应,升高温度,平衡向逆反应方向移动,从而抑制氨基磺酸的产率,故答案为:温度高,SO3气体逸出加快,使反应①转化率降低.温度高,反应①平衡向逆反应方向移动;
(3)当溶液变蓝色时,说明H2NSO3H恰好完全反应,氨基磺酸和亚硝酸钠的反应方程式为:H2NSO3H+NaNO2=NaHSO4+N2↑+H2O,根据方程式知,n (H2NSO3H)=n(NaNO2)=25.00×l0-3×0.08000 mol?L-1=2.000×l0-3 mol;
ω(H2NSO3H)=
| 2.000×10-3mol×97g/mol | ||
7.920g×
|
(4)用氢氧化钠测定氨基磺酸的纯度,测定结果通常比NaNO2法偏高,说明还有其它物质和氢氧化钠反应,能和氢氧化钠反应的物质是硫酸,故答案为:硫酸.
点评:本题考查测定物质的含量、化学平衡等知识点,会根据题给信息进行分析解答是解本题关键,难度较大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目

 (2011?南京三模)核能源已日益成为当今世界的主要能源.
(2011?南京三模)核能源已日益成为当今世界的主要能源.