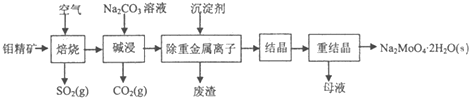
题目内容
 (2011?南京三模)核能源已日益成为当今世界的主要能源.
(2011?南京三模)核能源已日益成为当今世界的主要能源.(1)核能原料UO2可通过三碳酸铀酰铵(NH4)4[UO2 (CO3)3]直接煅烧还原制得.UO2晶体属CaF2型面心立方结构(CaF2的晶胞示意图如图),则UO2晶体U4+的配位数为
8
8
;三碳酸铀酰铵中含有化学键类型有ABCE
ABCE
;A.离子键 B.σ键 C.π键 D.氢键 E.配位键
根据价层电子对互斥理论推测CO32-的空间构型为
平面三角形
平面三角形
;写出一种与CO32-互为等电子体且属于非极性分子的微粒的化学式SO3或BF3
SO3或BF3
.(2)为了获得高浓度的235U,科学家们采用“气体扩散法”:到目前为止,UF6是唯一合适的化合物.UF6在常温常压下是固体,在56.4℃即升华成气体.UF6属于
分子
分子
晶体.’(3)放射性碘是重要的核裂变产物之一,因此放射性碘可以作为核爆炸或核反应堆泄漏事故的信号核素.写出131I基态原子的价电子排布式
5s25p5
5s25p5
.分析:(1)在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,据此判断UO2晶体U4+的配位数,阴阳离子之间存在离子键,非金属元素之间形成共价键,共价单键为σ键,共价双键中一个σ键一个π键,含有孤电子对的原子和含有空轨道的原子之间形成配位键,根据价层电子对互斥理论确定离子空间构型,原子个数相同价电子数相同的微粒为等电子体,正负电荷重心重合的分子为非极性分子;
(2)一般来说,熔点较小的晶体为分子晶体;
(3)I原子是53号元素,其原子核外有53个电子,根据构造原理写出其价电子排布式.
(2)一般来说,熔点较小的晶体为分子晶体;
(3)I原子是53号元素,其原子核外有53个电子,根据构造原理写出其价电子排布式.
解答:解:(1)根据图片知,在CaF2晶胞每个钙离子的配位数是8,所以UO2晶体U4+的配位数为8,(NH4)4[UO2 (CO3)3]中含有离子键、σ键、π键、配位键,不存在氢键,故选ABCE,CO32-中价层电子数=3+
(4+2-3×2)=3,且不含孤电子对,所以是平面三角形构型,与CO32-互为等电子体且属于非极性分子的微粒的化学式SO3或BF3,
故答案为:8;ABCE;平面正三角形;SO3或BF3;
(2)一般来说,熔点较小的晶体为分子晶体,所以UF6属于分子晶体,故答案为:分子;
(3)131I属于第5周期第VIIA元素,I原子最外层电子就是其价电子,其价电子中5s轨道排了2个电子,5p轨道排了5个电子,所以131I基态原子的价电子排布式5s25p5,
故答案为:5s25p5.
| 1 |
| 2 |
故答案为:8;ABCE;平面正三角形;SO3或BF3;
(2)一般来说,熔点较小的晶体为分子晶体,所以UF6属于分子晶体,故答案为:分子;
(3)131I属于第5周期第VIIA元素,I原子最外层电子就是其价电子,其价电子中5s轨道排了2个电子,5p轨道排了5个电子,所以131I基态原子的价电子排布式5s25p5,
故答案为:5s25p5.
点评:本题考查物质结构和性质,根据核外电子排布式的书写规则、离子构型的判断方法等知识来分析解答,易错点是等电子体的判断,注意基础知识的积累.

练习册系列答案
相关题目