题目内容
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入 2mL 浓硫酸、3mL 乙醇和 2mL 乙酸的混合溶液。
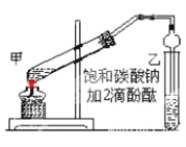
②按如图连接好装置(装置气密性良好)并加入混合液,小火均匀地加热 3-5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)若实验中用乙酸和含18O 的乙醇作用,该反应的化学方程式是_____。
(2)甲试管中,混合溶液的加入顺序:_____;
(3)步骤②中需要用小火均匀加热,其主要原因是___________;
(4)上述实验中饱和碳酸钠溶液的作用是_____(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是_____;分离时,乙酸乙酯应该从仪器_____(填:“下口放”或“上口倒”)出。
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有_____(填序号)。
①混合物中各物质的浓度不再变化;
②单位时间里,生成 1mol 乙醇,同时生成 1mol 乙酸;
③单位时间里,生成 1mol 乙酸乙酯,同时生成 1mol 乙酸。
(7)若现有乙酸 90g,乙醇 138g 发生酯化反应得到 88g 乙酸乙酯,试计算该反应的产品产率为_____。(产率%=(实际产量/理论产量)×100%)
【答案】CH3COOH+CH3CH218OH![]() CH3CO18OC2H5+H2O 先加入乙醇,再沿壁慢慢加入浓硫酸,冷却后再加入乙酸 减少原料损失、减少副产物 BC 分液漏斗 上口 ①③ 66.7%
CH3CO18OC2H5+H2O 先加入乙醇,再沿壁慢慢加入浓硫酸,冷却后再加入乙酸 减少原料损失、减少副产物 BC 分液漏斗 上口 ①③ 66.7%
【解析】
在试管中分别加入乙醇、浓硫酸、乙酸,由于有机物沸点较低,为了减少原料的损失及副产物过多,反应时小火加热,酯化时酸脱羟基醇脱氢,用饱和碳酸钠溶液接收生成物,可以更好的实现产品与杂质的分离,最后通过分液得到纯净的乙酸乙酯。
(1)酯化反应的原理是酸脱羟基醇脱氢,若实验中用乙酸和含18O 的乙醇作用,该反应的化学方程式是:CH3COOH+CH3CH218OH![]() CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
(2)该实验中用到的药品有乙醇、乙酸、浓硫酸,乙醇密度比浓硫酸小,先加入乙醇,再沿壁慢慢加入浓硫酸,冷却后再加入乙酸;
(3)步骤②中需要用小火均匀加热,其主要原因是减少原料损失、减少副产物;
(4)饱和碳酸钠可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,则上述实验中饱和碳酸钠溶液的作用是BC;
(5)要将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器是分液漏斗,分离时,乙酸乙酯的密度比水小,应该从分液漏斗上口倒出;
(6)①混合物中各物质的浓度不再变化,说明可逆反应达到平衡,可以作为判断依据;
②单位时间里,生成 1mol 乙醇,同时生成 1mol 乙酸,都为逆反应,没有体现正逆反应关系,不能判断是否达到平衡;
③单位时间里,生成 1mol 乙酸乙酯,同时生成 1mol 乙酸,可知正逆反应速率相等,可以判断达到平衡状态,故答案为①③;
(7)现有乙酸 90g,乙醇 138g 发生酯化反应得到 88g 乙酸乙酯,乙酸、乙醇的物质的量分别为:![]() =1.5mol、
=1.5mol、![]() =3mol,由反应方程式可知乙醇过量, 90g乙酸完全反应理论上生成乙酸乙酯为
=3mol,由反应方程式可知乙醇过量, 90g乙酸完全反应理论上生成乙酸乙酯为![]() =132g,该反应产品的产率为
=132g,该反应产品的产率为![]() 100%=66.7%。
100%=66.7%。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度 | 水溶性 |
A | C2H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是( )
A.分馏B.升华C.萃取D.分液