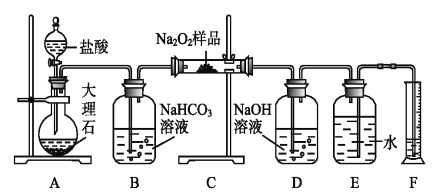
题目内容
【题目】某气态烷烃和某气态单烯烃(只含一个碳碳双键)组成的混合气体在同温、同压下是氢气密度的13倍,取标准状况下此混合气体4.48L,通入足量溴水中,溴水质量增加2.8g,则此混合气体可能是( )
A.甲烷和丙烯B.乙烷和丙烯
C.甲烷和2-甲基丙烯D.乙烷和1-丁烯
【答案】C
【解析】
混合气态烃的平均相对分子质量为![]() ,由于最简单的烯烃即乙烯的相对分子质量为28,故一定有甲烷,计算混合气体物质的量,再根据
,由于最简单的烯烃即乙烯的相对分子质量为28,故一定有甲烷,计算混合气体物质的量,再根据![]() 计算混合气体的质量,溴水增重2.8g为烯烃的质量,则可计算出烯烃的物质的量,进而确定其分子式和名称。据此分析。
计算混合气体的质量,溴水增重2.8g为烯烃的质量,则可计算出烯烃的物质的量,进而确定其分子式和名称。据此分析。
混合气态烃的平均相对分子质量为![]() ,由于最简单的烯烃即乙烯的相对分子质量为28,故一定有甲烷;标准状况下此混合气体4.48L,物质的量为
,由于最简单的烯烃即乙烯的相对分子质量为28,故一定有甲烷;标准状况下此混合气体4.48L,物质的量为![]() ,故混合气体的总质量为
,故混合气体的总质量为![]() ,溴水增重为烯烃的增重即2.8g,故甲烷的质量为2.4g,甲烷物质的量为
,溴水增重为烯烃的增重即2.8g,故甲烷的质量为2.4g,甲烷物质的量为![]() ,烯烃的物质的量为
,烯烃的物质的量为![]() ,烯烃的摩尔质量为
,烯烃的摩尔质量为![]() ,则烯烃的分子式为C4H8,可以是1-丁烯、2-丁烯,或2-甲基丙烯,故C正确;答案选C。
,则烯烃的分子式为C4H8,可以是1-丁烯、2-丁烯,或2-甲基丙烯,故C正确;答案选C。

练习册系列答案
相关题目