题目内容
【题目】铬酸铅(PbCrO4)俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
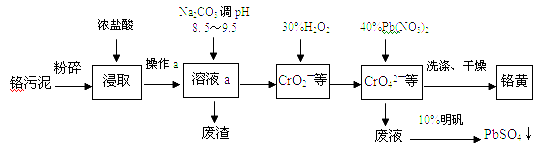
(1)铬黄中,铬的化合价为 价
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 ,操作a的名称为
(3)写出加入30%H2O2过程中发生的离子反应方程式
(4)在废液中加入10%明矾溶液发生反应的离子方程式为
(5)对含铬废水进行处理的方法是:将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①写出Fe2+和Cr2O72-发生反应的离子方程式
请分析电解过程中溶液pH不断上升的原因
【答案】(1)+6;(2)Fe2O3+6H+=2Fe3++3H2O;过滤;
(3)2CrO2—+3H2O2+2OH-=2CrO42-+4H2O;(4)SO42-+Pb2+=PbSO4↓;
(5)①6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②电解时阴极消耗氢离子,亚铁离子还原Cr2O72-也消耗氢离子,所以pH不断上升。
【解析】
试题分析:(1)Pb以+2价稳定,根据铬酸铅的化学式,O为-2价,Pb为+2价,化合价代数和为0,因此Cr为+6价;(2)Fe2O3属于碱性氧化物,因此反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;操作a得到滤液和滤渣,因此操作名称为过滤;(3)利用过氧化氢的氧化性,把Cr3+氧化成+6价Cr,离子反应方程式为:2CrO2—+3H2O2+2OH-=2CrO42-+4H2O;(4)根据流程图,加入明矾的作用,发生SO42-+Pb2+=PbSO4↓;(5)①根据Cr2O72-的强氧化性,把Fe2+氧化成Fe3+,其离子反应方程式为:6Fe2+ + Cr2O72-+14H+ = 6Fe3+ + 2Cr3+ + 7H2O;②电解时阴极消耗氢离子,亚铁离子还原Cr2O72-也消耗氢离子,所以pH不断上升。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案